题目内容
现取m克铝镁合金与一定浓度的稀硝酸恰好完全溶解(假定硝酸的还原产物只有NO),向反应后的混合溶液中滴加bmol/LNaOH溶液,当滴加到VmL时,得到沉淀质量恰好为最大值n克,则下列有关该实验的说法中不正确的是( )
分析:本题涉及到的反应有:Al+4HNO3(稀)=Al(NO3)3+NO↑+2H2O; 3Mg+8HNO3 (稀)=3Mg(NO3)2+2NO↑+4H2O
Al(NO3)3+3NaOH=Al(OH)3↓+3NaNO3; Mg(NO3)2+2NaOH=Mg(OH)2↓+2NaNO3
A、根据酸根离子与钠离子的物质的量相等,即n(NO3-)=n(Na+)=n(NaOH)进行计算;
B、根据质量守恒定律,在沉淀中,氢氧根的物质的量等于Mg2+、Al3+所带电荷的物质的量,也等于合金失去电子的物质的量,即为反应过程中转移的电子来进行计算;
C、分析题中信息,根据气体没有标明存在状态是否标准状态来判断;
D、根据质量守恒,硝酸有两种作用,作为酸的硝酸(生成硝酸盐)的物质的量等于硝酸钠的物质的量,作氧化剂的硝酸的物质的量等于NO的物质的量进行计算.
Al(NO3)3+3NaOH=Al(OH)3↓+3NaNO3; Mg(NO3)2+2NaOH=Mg(OH)2↓+2NaNO3
A、根据酸根离子与钠离子的物质的量相等,即n(NO3-)=n(Na+)=n(NaOH)进行计算;
B、根据质量守恒定律,在沉淀中,氢氧根的物质的量等于Mg2+、Al3+所带电荷的物质的量,也等于合金失去电子的物质的量,即为反应过程中转移的电子来进行计算;
C、分析题中信息,根据气体没有标明存在状态是否标准状态来判断;
D、根据质量守恒,硝酸有两种作用,作为酸的硝酸(生成硝酸盐)的物质的量等于硝酸钠的物质的量,作氧化剂的硝酸的物质的量等于NO的物质的量进行计算.
解答:解:A、当沉淀量最大时,溶液中的溶质只有硝酸钠(NaNO3),硝酸根离子与钠离子的物质的量相等,n(NO3-)=n(Na+)=n(NaOH)=
mol,故A正确;
B、至沉淀量最大,生成的n克沉淀为氢氧化铝和氢氧化镁.根据质量守恒定律,其中镁、铝元素的质量等于m克合金的质量,所以沉淀中氢氧根的质量为(n-m)克,在沉淀中,氢氧根的物质的量等于Mg2+、Al3+所带电荷的物质的量,也等于合金失去电子的物质的量,即为反应过程中转移的电子,n(e-)=n(OH-)=
mol,故B正确;
C、根据电子守恒原理,生成NO时是HNO3中+5价的N原子得3个电子,因此生成NO的物质的量应该是转移电子的三分之一,即
×
=
mol,其体积在标准状况下为为
L,但是选项中没有说明状态,则此时的体积不能确定,故C错误;
D、参加反应的硝酸有两种作用,作为酸的硝酸(生成硝酸盐)的物质的量等于硝酸钠的物质的量,即
mol,作氧化剂的硝酸的物质的量等于NO的物质的量,即
mol,所以与合金反应的硝酸的物质的量为(
+
)mol,故D正确.
故选C.
| bv |
| 1000 |
B、至沉淀量最大,生成的n克沉淀为氢氧化铝和氢氧化镁.根据质量守恒定律,其中镁、铝元素的质量等于m克合金的质量,所以沉淀中氢氧根的质量为(n-m)克,在沉淀中,氢氧根的物质的量等于Mg2+、Al3+所带电荷的物质的量,也等于合金失去电子的物质的量,即为反应过程中转移的电子,n(e-)=n(OH-)=
| n-m |
| 17 |
C、根据电子守恒原理,生成NO时是HNO3中+5价的N原子得3个电子,因此生成NO的物质的量应该是转移电子的三分之一,即
| n-m |
| 17 |
| 1 |
| 3 |
| n-m |
| 51 |
| 22.4(n-m) |
| 51 |
D、参加反应的硝酸有两种作用,作为酸的硝酸(生成硝酸盐)的物质的量等于硝酸钠的物质的量,即
| bv |
| 1000 |
| n-m |
| 51 |
| n-m |
| 51 |
| bv |
| 1000 |
故选C.
点评:本题结合铝镁与硝酸反应,生成的盐与氢氧化钠反应的特点,综合考查学生的得失电子守恒、溶液电中性原理、质量守恒的综合计算能力,考虑到现在学生的实际能力水平,题目以多项说法形式呈现,同时也考查了学生的学习综合能力和关注细节解决复杂问题的能力,总之这是一道考查能力的好题.

练习册系列答案
相关题目
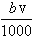 mol
mol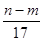 mol
mol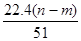 L
L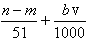 mol
mol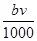 mol
mol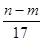 mol
mol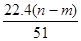 L
L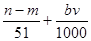 )mol
)mol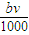 mol
mol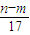 mol
mol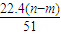 L
L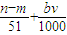 )mol
)mol