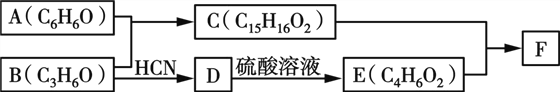
题目内容
【题目】2Zn(OH)2·ZnCO3是制备活性ZnO的中间体,以锌焙砂(主要成分为ZnO,含少量Cu2+、Mn2+等离子)为原料制备2Zn(OH)2·ZnCO3的工艺流程如下:

(1)用(NH4)2SO4与NH3·H2O的混合溶液浸取锌焙砂生成[Zn(NH3)4]2+的过程中加入H2O2的目的是________。
(2)加入(NH4)2S除杂过程中的主要离子方程式为________。
(3)过滤3所得滤液可循环使用,其主要成分的化学式是_______。
(4)检验2Zn(OH)2·ZnCO3沉淀是否洗涤干净的方法是________。
(5)写出沉锌步骤中发生反应的化学方程式________。
【答案】将Mn2+氧化为MnO2除去Cu2++S2-=CuS↓(NH4)2SO4取最后一次洗涤液少许于试管中,滴加稀盐酸和BaCl2溶液,若无明显现象,则沉淀已洗涤干净3ZnSO4+6NH4HCO3=2Zn(OH)2·ZnCO3↓+5CO2↑+3(NH4)2SO4+H2O
【解析】
制备2Zn(OH)2·ZnCO3流程为:锌焙砂(主要成分为ZnO,含少量Cu2+、Mn2+等离子)中加入硫酸铵、氨水、双氧水,双氧水将锰离子氧化成二氧化锰,过滤后在滤液中加硫化铵,再过滤,除去铜离子,蒸氨除去多余的氨气,加入碳酸氢铵得到2Zn(OH)2·ZnCO3和二氧化碳气体,过滤得2Zn(OH)2·ZnCO3,滤液为硫酸铵溶液,据此解答。
(1)双氧水具有强氧化性,还原产物是水,不会引入新杂质,因此加入H2O2的目的是将锰离子氧化成二氧化锰而除去锰;
(2)根据以上分析可知加入(NH4)2S的目的是除去铜离子,则除杂过程中的主要离子方程式为Cu2++S2-=CuS↓;
(3)根据上面的分析可知,过滤3所得滤液为硫酸铵溶液,(NH4)2SO4可以循环使用;
(4)根据上面的分析可知,过滤3所得滤液为硫酸铵溶液,因此证明2Zn(OH)2·ZnCO3沉淀洗涤完全即证明沉淀洗涤滤液中有没有硫酸根离子,所以操作为取最后一次洗涤液少许于试管中,滴加稀盐酸和BaCl2溶液,若无明显现象,则沉淀已洗涤干净;
(5)加入碳酸氢铵得到2Zn(OH)2·ZnCO3和二氧化碳气体,根据原子守恒可知还有硫酸铵和水生成,则沉锌步骤中发生反应的化学方程式为3ZnSO4+6NH4HCO3=2Zn(OH)2·ZnCO3↓+5CO2↑+3(NH4)2SO4+H2O。