题目内容
【题目】水合肼(N2H4H2O)是无色、有强还原性的液体,能与水、醇任意混合,不溶于乙醚和氯仿。实验室制备水合肼的原理为:CO(NH2)2+2NaOH+NaClO═Na2CO3+N2H4H2O+NaCl,据此,某学生设计了下列实验。
已知:①NaClO受热易分解为NaCl和NaClO3
②N2H4H2O的沸点约118℃
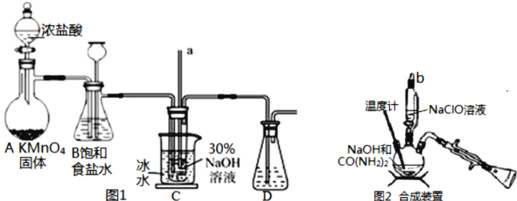
Ⅰ.制备NaClO溶液(如图1)
(1)用烧碱固体配制30%NaOH溶液时,所需玻璃仪器除玻璃棒外还有___(填字母)。
A.容量瓶 B.移液管 C.烧杯 D.量筒
(2)B中的长颈漏斗和C中的玻璃管a在实验中的作用相同,均为___。C中用冰水浴控制温度在25℃以下,其主要目的是___。
Ⅱ.制取水合肼(如图2)
(3)实验中要滴入NaClO溶液___(选填“需要”或“不需要”)打开玻璃塞b。
(4)反应过程中,若将CO(NH2)2滴加到NaClO中,将会产生大量氮气,降低水合肼的产率,原因是___(用化学方程式表示)。充分反应后,把“合成装置”内的溶液经过___(填操作)处理,即可得到水合肼的粗产品。
Ⅲ.定量测定
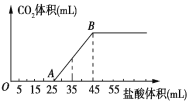
(5)称取馏分0.20g,加水配成20.00mL溶液,在一定条件下,用0.30molL-1I2的标准液进行滴定。
①滴定时,用___(填仪器名称)装标准液。
②水合肼与I2反应的化学方程式为___。
③实验测得消耗I2溶液的平均值为20.00mL,则馏分中N2H4H2O的质量分数为___。
【答案】CD 平衡压强 降低C中反应温度,防止温度太高使NaClO分解或发生歧化反应 不需要 N2H4H2O+2NaClO=N2↑+3H2O+2NaCl 蒸馏 酸式滴定管 N2H4H2O+2I2═N2↑+4HI+H2O 75%
【解析】
装置Ⅰ:二氧化锰与浓盐酸反应制取氯气,制取的氯气中含有氯化氢,装置C中玻璃管的作用为平衡压强,氯气与氢氧化钠反应制备NaClO,C中用冰水浴控制温度在30℃以下,防止NaClO(歧化)分解为氯酸钠和氯化钠,最后进行尾气处理。
制取水合肼:根据仪器的特征分析解答;N2H4H2O具有强还原性,容易被过量的NaClO氧化;
(1)配制30%NaOH溶液时,用天平称量质量,在烧杯中加水溶解,并用玻璃棒搅拌,需要玻璃仪器有:烧杯、玻璃棒;
(2)二氧化锰与浓盐酸反应生成氯化锰、氯气与水,反应离子方程式为MnO2+4H++2Cl-△Mn2++Cl2↑+2H2O,发生堵塞时,压强增大,B和C长玻璃管中液面上升,形成水柱,可观察装置是否堵塞,作安全瓶,能平衡压强;由于温度升高时,次氯酸钠容易发生自身的氧化还原反应生成氯酸钠和氯化钠,所以冰水浴温度需要在30℃以下,其主要目的是防止NaClO(歧化)分解为氯酸钠和氯化钠。
(3)仪器为三颈烧瓶,实验中要滴入NaClO溶液不需要打开玻璃塞b。
(4)反应过程中,若将CO(NH2)2滴加到NaClO中,将会产生大量氮气,降低水合肼的产率,N2H4H2O具有强还原性,容易被过量的NaClO氧化, N2H4H2O+2NaClO=N2↑+3H2O+2NaCl。充分反应后,把“合成装置”内的溶液经过蒸馏处理,即可得到水合肼的粗产品。
(5)称取馏分0.20g,加水配成20.00mL溶液,在一定条件下,用0.30molL-1I2的标准液进行滴定。
①滴定时,0.30molL-1I2的标准液显酸性,用酸式滴定管。
②根据氧化还原反应原理,水合肼与I2反应的化学方程式为N2H4H2O+2I2═N2↑+4HI+H2O。
③根据方程系数关系,实验测得消耗I2溶液的平均值为20.00mL,则馏分中N2H4H2O的质量分数为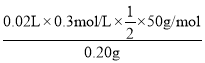 ×100%=75%。
×100%=75%。

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案【题目】铁及碳的化合物在社会生产、生活中有着广泛的应用。请回答下列问题:
(1)磁铁矿是工业上冶炼铁的原料之一。
已知:①Fe3O4(s)+4C(s)![]() 3Fe(s)+4CO(g) △H=+646.0kJmol﹣1
3Fe(s)+4CO(g) △H=+646.0kJmol﹣1
②C(s)+CO2(g)2CO(g) △H=+172.5kJmol﹣1
则Fe3O4(s)+4CO(g)![]() 3Fe(s)+4CO2(g)△H=___。
3Fe(s)+4CO2(g)△H=___。
(2)反应Fe(s)+CO2(g)![]() FeO(s)+CO(g)△H的平衡常数为K,在不同温度下,K值如下:
FeO(s)+CO(g)△H的平衡常数为K,在不同温度下,K值如下:
温度/K | 973 | 1173 | 1373 | 1573 |
K | 1.47 | 2.15 | 3.36 | 8.92 |
①从表中数据可推断,该反应是___(填“放热”或“吸热”)反应。
②温度为973K时,在某恒容密闭容器中发生上述反应。下列有关说法能说明该反应已达到平衡状态的是___(填字母)。
A.c(CO2)=c(CO)
B.v正(CO2)=v逆(CO)
C.体系压强不变
D.混合气体中c(CO)不变
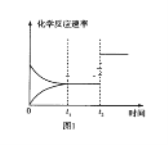
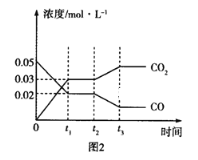
(3)如图图1、2表示反应:H2(g)+CO2(g)![]() CO(g)+H2O(g)△H>0有关量与反应时间之间的关系:
CO(g)+H2O(g)△H>0有关量与反应时间之间的关系:
①图2中若t1=0.5min,则0~t1时间段内,H2O的平均反应速率v(H2O)=___molL﹣1s﹣1。
②图1中t2时刻改变的条件是___(任写两种,下同);图2中t2时刻改变的条件是___。
【题目】现有部分短周期元素的原子结构如下表:
元素编号 | 元素原子结构 |
X | 原子结构示意图为 |
Y | 最外层电子数是次外层电子数的2倍 |
Z | 原子核内含有12个中子,且其离子的结构示意图为 |
(1)写出X的元素符号:____________,元素Y的最简单氢化物的化学式为______________。
(2)Z元素原子的相对原子质量为____________。
(3)X和Z两种元素的最高价氧化物对应的水化物相互反应的离子方程式为______________。
(4)Y和Z两种元素的最高价氧化物发生氧化还原反应的化学方程式为__________________。