题目内容
10.研究CO2的利用对促进低碳社会的构建具有重要意义.(1)将CO2与焦炭作用生成CO,CO可用于炼铁等.
已知:①Fe2O3(s)+3C(s,石墨)═2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1
②C(s,石墨)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1
则CO还原Fe2O3(s)的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5 kJ•mol-1.
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H
①该反应的平衡常数表达式为K=$\frac{c(C{H}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$.
②取一定体积CO2和H2的混合气体(物质的量之比为1:3),加入恒容密闭容器中,发生上述反应反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图1所示,则该反应的△H<(填“>”、“<”或“=”,下同)0.
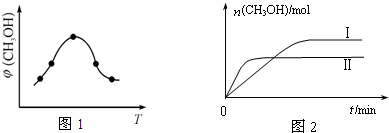
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图2所示,曲线I、Ⅱ对应的平衡常数关系为KⅠ>KⅡ.
(3)以CO2为原料还可以合成多种物质.
①工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成,其反应方程式为2NH3+CO2
 CO(NH2)2+H2O.开始以氨碳比$\frac{n(N{H}_{3})}{n(C{O}_{2})}$=3进行反应,达平衡时CO2的转化率为60%,则NH3的平衡转化率为40%.
CO(NH2)2+H2O.开始以氨碳比$\frac{n(N{H}_{3})}{n(C{O}_{2})}$=3进行反应,达平衡时CO2的转化率为60%,则NH3的平衡转化率为40%.②用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,该电极反应的方程式为CO2+8e-+8H+=CH4+2H2O.
③将足量CO2通入饱和氨水中可得氮肥NH4HCO3,已知常温下一水合氨Kb=1.8×10-5,碳酸一级电离常数Ka=4.3×10-7,则NH4HCO3溶液呈碱性(填“酸性”、“中性”或“碱性”).
分析 (1)已知:①Fe2O3(s)+3C(s,石墨)═2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1
②C(s,石墨)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1
根据盖斯定律,①-②×3可得:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g);
(2)①化学平衡常数是可逆反应达到平衡状态时各种生成物浓度的化学计量数幂指数的乘积与各种反应物浓度的化学计量数幂指数的乘积的比;
②由甲醇的体积分数φ(CH3OH)与反应温度T的关系图示可知:当反应达到平衡后,升高温度,甲醇的体积分数减小,说明升高温度,化学平衡逆向移动;
③曲线Ⅱ比I先达到平衡,说明曲线Ⅱ的反应速率快,平衡时曲线Ⅱ甲醇的物质的量较小,说明平衡向逆反应进行,由于正反应为气体体积减小的反应,不能是增大压强,说明温度曲线Ⅱ>I,由于温度高,CH3OH含量低,说明化学平衡常数减小;
(3)①由CO2和NH3在一定条件下合成尿素[CO(NH2)2],根据质量守恒定律书写方程式;
假设n(CO2)=1 mol,则n(NH3)=3mol.由于达平衡时CO2的转化率为60%,所以反应消耗的n(CO2)=0.6 mol,根据方程式可知反应的NH3的物质的量,进而计算氨气的转化率;
②用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,酸性条件下还有水生成;
③根据电离常数可知HCO3-水解强于NH4+水解,故显弱碱性.
解答 解:(1)已知:①Fe2O3(s)+3C(s,石墨)═2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1
②C(s,石墨)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1
根据盖斯定律,①-②×3可得:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5 kJ•mol-1,
故答案为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5 kJ•mol-1;
(2)①CO2(g)+3H2(g)?CH3OH(g)+H2O(g)的平衡常数表达式K=$\frac{c(C{H}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$,
故答案为:$\frac{c(C{H}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$;
②由甲醇的体积分数φ(CH3OH)与反应温度T的关系图示可知:当反应达到平衡后,升高温度,甲醇的体积分数减小,说明升高温度,化学平衡逆向移动,升高温度平衡向吸热反应方向移动,逆反应方向为吸热反应,所以正反应为放热反应,所以△H<0,
故答案为:<;
③曲线Ⅱ比I先达到平衡,说明曲线Ⅱ的反应速率快,平衡时曲线Ⅱ甲醇的物质的量较小,说明平衡向逆反应进行,由于正反应为气体体积减小的反应,不能是增大压强,说明温度曲线Ⅱ>I,由于温度高,CH3OH含量低,说明化学平衡常数KⅠ>KⅡ,
故答案为:>;
(3)①根据质量守恒定律,由CO2和NH3在一定条件下合成尿素[CO(NH2)2]的反应方程式为:2NH3+CO2 CO(NH2)2+H2O,
CO(NH2)2+H2O,
假设n(CO2)=1 mol,则n(NH3)=3mol,由于达平衡时CO2的转化率为60%,所以反应消耗的n(CO2)=0.6 mol,根据方程式可知反应的NH3的物质的量n(NH3)=1.2 mol,所以氨气的转化率为(1.2 mol÷3mol)×100%=40%,
故答案为:2NH3+CO2 CO(NH2)2+H2O;40%;
CO(NH2)2+H2O;40%;
②用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,该电极反应的方程式为:CO2+8e-+8H+=CH4+2H2O,故答案为:CO2+8e-+8H+=CH4+2H2O;
③一水合氨的电离常数大于HCO3-的电离常数,可知HCO3-水解程度强于NH4+水解程度,故NH4HCO3溶液呈弱碱性,故答案为:碱性.
点评 本题考查化学平衡有关计算及影响因素、热化学方程式书写、原电池、电离平衡常数等,是对学生综合能力的考查,难度中等.

 教材全解字词句篇系列答案
教材全解字词句篇系列答案| A. |  制备Fe(OH)2 | B. |  实验室制备乙炔 | ||
| C. |  从碘与NaCl混合液中分离出碘 | D. |  比较白磷、红磷的着火点 |
| A. | SiO2是酸性氧化物,但不与水反应 | |
| B. | 泡花碱属于盐类 | |
| C. | 明矾和漂白粉均可用于自来水的杀菌、消毒 | |
| D. | 玻璃和陶瓷都属于传统硅酸盐材料 |
 苯甲醛在浓碱的条件下能发生歧化反应生成苯甲醇和苯甲酸盐.某实验小组利用该原理制备纯净的苯甲酸.
苯甲醛在浓碱的条件下能发生歧化反应生成苯甲醇和苯甲酸盐.某实验小组利用该原理制备纯净的苯甲酸.
查阅相关文献,可能用到的有关数据如下:
表1:有关物质的密度、沸点、溶解性
| 物质 | 相对分子 质量 | 密度/ (相对于水) | 沸点/℃ | 溶解性 |
| 苯甲醛 | 106 | 1.046 | 178.8 | 微溶于水,可混溶于乙醇、乙醚、苯、氯仿 |
| 苯甲醇 | 108 | 1.042 | 205.7 | 溶于水,易溶于乙醇、醚、芳烃 |
| 苯甲酸 | 122 | 1.271 | 249.2 | 微溶于水,易溶于乙醇、乙醚、氯仿、苯、二硫化碳、四氯化碳 |
| 苯甲酸钠 | 144 | 1.442 | 249.3 | 溶于水和乙醇、甘油、苯、甲醇、微溶于乙醚 |
| 温度/℃ | 25 | 50 | 95 |
| 溶解度/g | 0.17 | 0.95 | 6.8 |
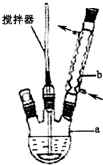
(1)写出装置图中玻璃仪器的名称,a三颈烧瓶,b(球形)冷凝管.
(2)为了进一步提纯苯甲酸,通常采用重结晶法进行.在进行该实验过程中需要趁热过滤.将粗笨甲酸全溶后往往需要再加入少量蒸馏水的目的是为了减少趁热过滤过程中损失苯甲酸.
(3)将提炖后的产品进行洗涤、干燥.检验经上述操作后得到的是否是纯净的苯甲酸的常用方法是测定获得产品的熔点是否是122.4℃.
(4)在整个过程中,若苯甲醛所取的质量为2.120g,最终获取的纯净笨甲酸的质量为1.098g,则苯甲酸的产率为90.0%.
(5)某同学认为可从弃去的萃取有机层中获取笨甲醇,为完成该实验需要的玻璃仪器有温度计、尾接管及蒸馏烧瓶、直形冷凝管、锥形瓶.
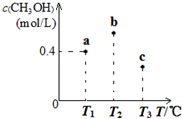
| A. | a容器中,0~5min内平均反应速率ν(H2)=0.04mol/(L.min) | |
| B. | 反应均进行到5min时,三个容器中一定达到化学平衡状态的是b | |
| C. | 当三个容器内的反应都达到化学平衡时,CO转化率最大的是a | |
| D. | 保持温度和容积不变,若开始时向b容器中充入0.6mol CO(g)、1.2mol H2(g)和0.4mol CH3OH(g),则反应开始时ν正(H2)<ν(逆) |
| A. | Na与氧气 | B. | 澄清石灰水与二氧化碳 | ||
| C. | 碳与氧气 | D. | 过氧化钠和水 |

 A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸,如图所示:
A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸,如图所示: