题目内容
1.短周期元素A、B、C、D的原子序数依次递增,它们的原子序数之和为32,原子最外层电子数之和为10.A与C同主族,B与D同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数.则下列叙述正确的是( )| A. | 一定条件下,B单质能置换出D单质,C单质能置换出A单质 | |
| B. | D元素处于元素周期表中第3周期第IV族 | |
| C. | C的最高价氧化物中含有共价键 | |
| D. | 四种元素的原子半径:A>B>D>C |
分析 短周期元素A、B、C、D的原子序数依次递增,B与D为同主族元素,B的原子序数大于A,故B处于第二周期,D处于第三周期,A与C同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数,设A的最外层电子数为x,则2x=2,x=1,则A、C处于IA族,四元素原子最外层电子数之和为10,故B、D的最外层电子数为$\frac{10-1-1}{2}$=4,故B、D处于ⅣA族,B为碳元素,D为Si元素,C元素原子序数大于碳元素,故C为Na元素,四元素原子序数之和为32,故A元素的原子序数为32-14-6-11=1,则A为H元素,以此解答该题.
解答 解:短周期元素A、B、C、D的原子序数依次递增,B与D为同主族元素,B的原子序数大于A,故B处于第二周期,D处于第三周期,A与C同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数,设A的最外层电子数为x,则2x=2,x=1,则A、C处于IA族,四元素原子最外层电子数之和为10,故B、D的最外层电子数为$\frac{10-1-1}{2}$=4,故B、D处于ⅣA族,B为碳元素,D为Si元素,C元素原子序数大于碳元素,故C为Na元素,四元素原子序数之和为32,故A元素的原子序数为32-14-6-11=1,则A为H元素.
A.高温条件下,碳和二氧化硅发生置换反应生成Si,钠和水发生置换反应生成氢气,故A正确;
B.D为Si元素,处于元素周期表中第3周期第IVA族,故B错误;
C.C的最高价氧化物为氧化钠,氧化钠中含有离子键,故C错误;
D.H原子半径最小,同主族电子层数越多原子半径越大,同一周期从左到右原子半径逐渐减小,则半径关系为A(H)<B(C)<D(Si)<C(Na),故D错误,
故选A.
点评 本题考查位置结构性质的关系,根据B的原子序数大于A,结合B、D为同主族元素,明确元素B为第二周期元素是解答本题的关键,题目难度中等.

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 “直接煤燃料电池”能够将煤中的化学能高效、清洁地转化为电能,如图是用固体氧化物作“直接煤燃料电池”的电解质.有关说法正确的是( )
“直接煤燃料电池”能够将煤中的化学能高效、清洁地转化为电能,如图是用固体氧化物作“直接煤燃料电池”的电解质.有关说法正确的是( )| A. | 电极b为电池的负极 | |
| B. | 电子由电极a沿导线流向b | |
| C. | 电池反应为:C+CO2═2CO | |
| D. | 煤燃料电池比煤直接燃烧发电能量利用率低 |
①$\frac{a}{NA}$ ②$\frac{12a}{b}$ ③aNA ④$\frac{12b}{a}$数,则下列各式中能表示该原子的相对原子质量数值的是( )
| A. | ①② | B. | ①④ | C. | ②④ | D. | ②③ |
| A. | ①⑦ | B. | ①⑧ | C. | ②⑧ | D. | ⑤⑨ |
 对此分析正确的是( )
对此分析正确的是( )| A. | 它是一种体型高分子化合物 | B. | 其单体是CH2=CH2和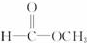 | ||
| C. | 其链节是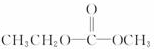 | D. | 其单体是 |
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
| A. | 甲醛、乙醛分子中的所有原子都在同一平面上 | |
| B. | 能发生银镜反应的有机物一定是醛 | |
| C. | 乙醛、丙醛都没有同分异构体 | |
| D. | 醛类既能氧化为羧酸又能还原为醇 |
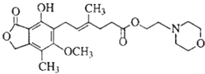
| A. | MMF能与碳酸钠溶液反应放出气体 | |
| B. | 1molMMF能与6mol氢气发生完全加成 | |
| C. | MMF遇三氯化铁溶液显紫色 | |
| D. | 1molMMF能与2molNaOH溶液完全反应 |