题目内容
9.下列各组物质按照单质、氧化物、酸、碱、盐分类顺序排列,其中正确的是( )| A. | 水银、干冰、硫酸、烧碱、纯碱 | B. | 碘酒、冰、硝酸、苛性钠、胆矾 | ||
| C. | 氢气、二氧化硫、盐酸、纯碱、硫酸铜 | D. | 铜、氧化铜、醋酸、熟石灰、石灰石 |
分析 根据概念进行判断:
单质是由一种元素组成的纯净物;
氧化物是有两种元素组成其中一种元素是氧元素的化合物;
酸是在水溶液中解离出来的阳离子全部是氢离子的化合物;
碱是在水溶液中解离出来的阴离子全部是氢氧根离子的化合物;
盐是在水溶液中解离出来金属离子或铵根离子和酸根离子的化合物.
解答 解:A、水银是金属单质,干冰是固态二氧化碳属于氧化物,硫酸属于酸、烧碱是氢氧化钠属于碱、纯碱碳酸钠属于盐,故A正确;
B、碘酒是碘的酒精溶液,是混合物,故B错误;
C、纯碱是碳酸钠,属于盐,不是碱,故C错误;
D、Cu是金属单质,CuO属于氧化物,醋酸属于酸、熟石灰氢氧化钙属于碱、石灰石碳酸钙属于盐,故D正确.
故选AD.
点评 本题考查单质、氧化物、酸、碱、盐的分类,题目难度不大,注意把握相关概念.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
3.以下微粒含配位键的是( )
①N2H4 ②Na3AlF6 ③OH- ④NH4+ ⑤PCl3 ⑥Fe(SCN)3 ⑦H3O+⑧[Ag(NH3)2]OH.
①N2H4 ②Na3AlF6 ③OH- ④NH4+ ⑤PCl3 ⑥Fe(SCN)3 ⑦H3O+⑧[Ag(NH3)2]OH.
| A. | ①②④⑤⑦⑧ | B. | ④⑤⑥⑦⑧ | C. | ②④⑥⑦⑧ | D. | 全部 |
17.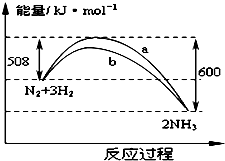 如图是425℃时N2与H2反应过程中能量变化的曲线图.下列叙述正确的是( )
如图是425℃时N2与H2反应过程中能量变化的曲线图.下列叙述正确的是( )
 如图是425℃时N2与H2反应过程中能量变化的曲线图.下列叙述正确的是( )
如图是425℃时N2与H2反应过程中能量变化的曲线图.下列叙述正确的是( )| A. | 该反应的热化学方程式为:N2+3H2?2NH3△H=-92kJ•mol-1 | |
| B. | 一定条件下N2+3H2═2NH3达到平衡时,3v正(H2)=2v逆(NH3) | |
| C. | 加入催化剂,该反应的反应热发生改变 | |
| D. | 温度、容器体积一定,通入1molN2和3molH2反应后放出的热量为Q1kJ,若通入2 molN2和6 molH2反应后放出的热量为Q2kJ,则有184>Q2>2Q1 |

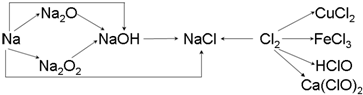
 2FeCl3.
2FeCl3.
 .
.