题目内容
在恒温下的密闭容器中,有可逆反应:2NO+O2 2NO2(正反应为放热反应),不能说明已经达到平衡状态的是( )
2NO2(正反应为放热反应),不能说明已经达到平衡状态的是( )
| A.正反应生成NO2的速率和逆反应生成O2的速率相等 |
| B.反应容器中压强不随时间的变化而变化 |
| C.混合气体颜色保持不变 |
| D.混合气体的平均相对分子质量不随时间变化而变化 |
A
解析

 一线名师权威作业本系列答案
一线名师权威作业本系列答案在密闭容器中,一定条件下进行如下反应NO(g)+CO(g)
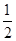 N2(g)+CO2(g),ΔH=-373.2 kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
N2(g)+CO2(g),ΔH=-373.2 kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
| A.加催化剂同时升高温度 | B.加催化剂同时增大压强 |
| C.升高温度同时充入N2 | D.降低温度同时增大压强 |
在某一恒温体积可变的密闭容器中发生如下反应: 时刻达到平衡后,在
时刻达到平衡后,在 时刻改变某一条件,其反应过程如图所示。下列说法正确的是
时刻改变某一条件,其反应过程如图所示。下列说法正确的是
A. |
| B.I、Ⅱ两过程达到平衡时,A的体积分数I>II |
C. 时刻改变的条件是向密闭容器中加C 时刻改变的条件是向密闭容器中加C |
| D.I、II两过程达到平衡时,平衡常数I<II |
已知CO和H2在一定条件下合成甲醇的反应为CO(g)+2H2(g)  CH3OH(g)。现在容积均为1 L的a、b、c三个密闭容器中分别充入1 mol CO和2 mol H2的混合气体,控制温度进行反应,测得相关数据的关系如图所示。下列说法正确的是( )
CH3OH(g)。现在容积均为1 L的a、b、c三个密闭容器中分别充入1 mol CO和2 mol H2的混合气体,控制温度进行反应,测得相关数据的关系如图所示。下列说法正确的是( )
| A.正反应的ΔH>0 |
| B.反应进行到5 min时,b容器中v正=v逆 |
| C.减压可将b中的平衡状态转变成c中的平衡状态 |
| D.达到平衡时,a、b、c中CO的转化率为b>a>c |
合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:
CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0
CO2(g)+H2(g) ΔH<0
反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )
| A.增加压强 | B.降低温度 |
| C.增大CO的浓度 | D.更换催化剂 |
对于化学反应方向的确定不仅与焓变(ΔH)有关,也与温度(T)、熵变(ΔS)有关,实验证明,化学反应的方向应由ΔH-TΔS确定,若ΔH-TΔS<0,则自发进行,否则不能自发进行。下列说法中,正确的是( )
| A.在温度、压强一定的条件下,焓因素和熵因素共同决定一个化学反应的方向 |
| B.温度、压强一定时,熵增加的反应一定能自发进行 |
| C.反应焓变是决定反应能否自发进行的唯一因素 |
| D.固体的溶解过程只与焓变有关 |
在一体积可变的密闭容器中,加入一定量的X、Y,发生反应mX(g) nY(g) ΔH="Q" kJ·mol-1。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
nY(g) ΔH="Q" kJ·mol-1。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
| 气体体积/L c(Y)/(mol·L-1) 温度/℃ | 1 | 2 | 3 |
| 100 | 1.00 | 0.75 | 0.53 |
| 200 | 1.20 | 0.90 | 0.63 |
| 300 | 1.30 | 1.00 | 0.70 |
下列说法正确的是( )
A.m>n
B.Q<0
C.温度不变,压强增大,Y的质量分数减小
D.体积不变,温度升高,平衡向逆反应方向移动
在密闭容器中进行如下反应:X2(g)+3Y2(g) 2Z(g),X2、Y2、Z的起始浓度分别为0.2 mol·L-1、0.6 mol·L-1、0.4 mol·L-1,当平衡时,下列数据肯定不正确的是( )
2Z(g),X2、Y2、Z的起始浓度分别为0.2 mol·L-1、0.6 mol·L-1、0.4 mol·L-1,当平衡时,下列数据肯定不正确的是( )
| A.X2为0.3 mol·L-1,Y2为0.9 mol·L-1 | B.Y2为1.0 mol·L-1 |
| C.X2为0.3 mol·L-1,Z为0.2 mol·L-1 | D.Z为1.0 mol·L-1 |
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)  2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5 L | 0.5 L | 1.0 L |
| 温度/℃ | T1 | T2 | T3 |
| 反应物起始量 | 1.5 mol A 0.5 mol B | 1.5 mol A 0.5 mol B | 6.0 mol A 2.0 mol B |
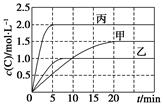
下列说法正确的是( )
A.10 min内甲容器中反应的平均速率v(A)=0.025 mol·L-1·min-1
B.由图可知:T1<T2,且该反应为吸热反应
C.x=1,若平衡时保持温度不变,改变容器体积平衡不移动
D.T1℃,起始时甲容器中充入0.5 mol A、1.5 mol B,平衡时A的转化率为25%