题目内容
【题目】25℃时,用0.10mol/L的氨水滴定10.00mL a mol/L的盐酸,混合溶液的pH与氨水的体积(V)的关系如图所示。已知N点溶液中存在:c(H+)=c(0H-)+c(NH3H2O),下列说法不正确的是
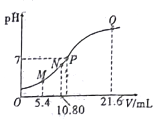
A. 图上四点离子种类相同
B. a=0.108
C. N、Q两点的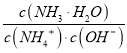 : N>Q
: N>Q
D. M点溶液中存在:c(H+)=c(OH-)+2(NH3H2O) +c(NH4+)
【答案】C
【解析】A. 盐酸与氨水混合后的溶液中只含有H+、NH4+、OH-、Cl-四种离子,所以图上四点离子种类相同,故A正确;B. N点溶液中存在的电荷守恒式为:c(H+)+c(NH4+)=c(OH-)+c(Cl-),已知N点溶液中存在:c(H+)=c(0H-)+c(NH3·H2O),联立得:c(NH3·H2O)+ c(NH4+)= c(Cl-),说明N点溶液中的溶质只有NH4Cl,即滴加10.8mL氨水时恰好与盐酸完全中和,所得溶液为NH4Cl溶液,由NH3·H2O+HCl=NH4Cl+H2O可知:0.10mol/L×10.8×10-3L=amol/L×10.00×10-3L,a=0.108,故B正确;C. 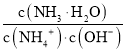 =
=![]() ,NH3·H2O的电离常数Kb(NH3·H2O)只随温度的变化而变化,恒温下电离常数不变,即N=Q,故C错误;D. M点滴加氨水5.4mL,完全反应后所得溶液为等浓度的HCl和NH4Cl的混合溶液,溶液中存在电荷守恒c(H+)+c(NH4+)=c(OH-)+c(Cl-)和物料守恒2c(NH3·H2O)+2c(NH4+)=c(Cl-),联立得:c(H+)=c(OH-)+2(NH3·H2O)+c(NH4+),故D正确;答案选C。
,NH3·H2O的电离常数Kb(NH3·H2O)只随温度的变化而变化,恒温下电离常数不变,即N=Q,故C错误;D. M点滴加氨水5.4mL,完全反应后所得溶液为等浓度的HCl和NH4Cl的混合溶液,溶液中存在电荷守恒c(H+)+c(NH4+)=c(OH-)+c(Cl-)和物料守恒2c(NH3·H2O)+2c(NH4+)=c(Cl-),联立得:c(H+)=c(OH-)+2(NH3·H2O)+c(NH4+),故D正确;答案选C。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案【题目】(题文)某研究小组制备氯气并对产生氯气的条件进行探究。
(1)装置A中用MnO2与浓盐酸反应制取Cl2,利用了浓HCl的______(填“氧化性”或“还原性”)。
(2)A中产生的气体不纯,含有的杂质可能是______。
(3)B用于收集Cl2,请完善装置B并用箭头标明进出气体方向。____________
(4)C用于吸收多余的Cl2,C中发生反应的离子方程式是______。
(5)该小组欲研究盐酸的浓度对制Cl2的影响,设计实验进行如下探究。
实验 | 操作 | 现象 |
I | 常温下将MnO2和12 mol·L-1浓盐酸混合 | 溶液呈浅棕色,略有刺激性气味 |
II | 将I中混合物过滤,加热滤液 | 生成大量黄绿色气体 |
III | 加热MnO2和4 mol·L-1稀盐酸混合物 | 无明显现象 |
①已知MnO2呈弱碱性。I中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,化学方程式是________。
②II中发生了分解反应,反应的化学方程式是________。
③III中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计实验IV进行探究:
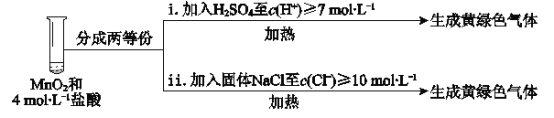
将实验III、IV作对比,得出的结论是________;将i、ii作对比,得出的结论是_______。