��Ŀ����
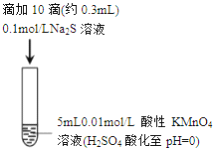
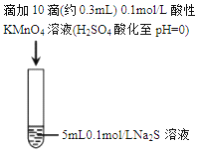
����Ŀ��ijС���о�Na2S ��Һ��KMnO4��Һ��Ӧ��̽����������
ʵ����� | I | II |
ʵ����� |
|
|
ʵ������ | ��ɫ��dz��pH | ��Һ�ʵ���ɫ��pH |
����: i.MnO4-��ǿ���������±���ԭΪMn2+���ڽ����������±���ԭΪMnO2
ii.�����������������Һ����Һ�ʵ���ɫ��
����˵����ȷ����
A. ����ʵ���֪��Na2S����ԭ
B. ȡʵ��I��������Һ����ʵ�飬����SO42-���ó�S2-��������SO42-
C. ʵ��I�з�Ӧ���ӷ���ʽ: 2MnO4-+3Mn2++2H2O=5MnO2��+4H+
D. ʵ��II �з�Ӧ��������Һ�ʵ���ɫ����MnO2����
���𰸡�C
��������A�ʵ��I��KMnO4����ԭ��MnO2��ʵ��II��KMnO4����ԭ��MnS��ʵ����Na2S��������A�����B�ʵ��I��KMnO4��Һ��H2SO4�ữ����Һ�е�SO42-��һ����S2-����������B�����C�ʵ��I����ɫ��dz˵��KMnO4��Һ������pH![]() 1����������i����������MnO4-Ӧ����ԭΪMn2+��ʵ��I�������غ�ɫ������˵��������MnO4-��Mn2+�������з�Ӧ����MnO2����Ӧ�����ӷ���ʽΪ2MnO4-+3Mn2++2H2O=5MnO2��+4H+��C����ȷ��D�����ʵ������ʵ��II��Ӧ��������Һ�ʵ���ɫ����MnS���ɣ�û��MnO2������ԭ���ǣ�ʵ��II��Һ��pH
1����������i����������MnO4-Ӧ����ԭΪMn2+��ʵ��I�������غ�ɫ������˵��������MnO4-��Mn2+�������з�Ӧ����MnO2����Ӧ�����ӷ���ʽΪ2MnO4-+3Mn2++2H2O=5MnO2��+4H+��C����ȷ��D�����ʵ������ʵ��II��Ӧ��������Һ�ʵ���ɫ����MnS���ɣ�û��MnO2������ԭ���ǣ�ʵ��II��Һ��pH![]() 8����������i�ڽ�����������MnO4-����ԭΪMnO2����Ӧ��������Һ�ʵ���ɫ����������ii����Ӧ���ɵ�S����Na2S��Һ��˵��Na2S����������Na2S��MnO2��Ӧ������MnS������D�����ѡC��
8����������i�ڽ�����������MnO4-����ԭΪMnO2����Ӧ��������Һ�ʵ���ɫ����������ii����Ӧ���ɵ�S����Na2S��Һ��˵��Na2S����������Na2S��MnO2��Ӧ������MnS������D�����ѡC��