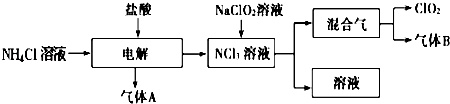
题目内容
【题目】现有一定量铝粉和铁粉的混合物与一定体积稀硝酸充分反应,反应过程中无气体放出(硝酸的还原产物是NH4NO3).在反应结束后的溶液中,逐滴加入2molL﹣1的NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量的关系如图所示.
(1)写出OA段反应的离子方程式: .
(2)B点时溶液中含有溶质的化学式为 .
(3)a的数值为 .
(4)原硝酸溶液中HNO3的物质的量为mol.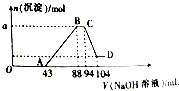
【答案】
(1)H++OH﹣=H2O
(2)NaNO3、NH4NO3
(3)0.03
(4)0.2
【解析】解:(1)铝粉和铁粉的混合物与一体积稀HNO3充分反应,反应后溶液中加入氢氧化钠溶液,由图可得硝酸过量,金属被氧化为Al3+、Fe3+ , 硝酸的还原产物是NH4NO3 , 当沉淀完全后,由图知继续加入氢氧化钠溶液,沉淀量不变,可知与NH4+发生了反应,则随着NaOH的滴加,发生的反应依次有:OA段为H++OH﹣=H2O,AB段为Fe3++3OH﹣=Fe(OH)3↓,Al3++3OH﹣=Al(OH)3↓,BC段为NH4++OH﹣═NH3H2O,CD段为Al(OH)3 +OH﹣=AlO ![]() +2H2O,所以答案是:H++OH﹣=H2O;(2)根据(1)分析可知,B点溶液中溶质为:NaNO3、NH4NO3 , 所以答案是:NaNO3、NH4NO3;(3)生成Fe(OH)3、Al(OH)3沉淀消耗氢氧化钠为(0.088﹣0.043)L×2mol/L=0.09mol,故Fe(OH)3、Al(OH)3的物质的量之和为
+2H2O,所以答案是:H++OH﹣=H2O;(2)根据(1)分析可知,B点溶液中溶质为:NaNO3、NH4NO3 , 所以答案是:NaNO3、NH4NO3;(3)生成Fe(OH)3、Al(OH)3沉淀消耗氢氧化钠为(0.088﹣0.043)L×2mol/L=0.09mol,故Fe(OH)3、Al(OH)3的物质的量之和为 ![]() =0.03mol,所以答案是:0.03;(4)由图可知,BC段消耗的氢氧化钠的体积为94mL﹣88mL=6mL,故该阶段参加反应的氢氧化钠为0.006L×2mol/L=0.012mol,根据NH4++OH﹣═NH3H2O 可知溶液中n(NH
=0.03mol,所以答案是:0.03;(4)由图可知,BC段消耗的氢氧化钠的体积为94mL﹣88mL=6mL,故该阶段参加反应的氢氧化钠为0.006L×2mol/L=0.012mol,根据NH4++OH﹣═NH3H2O 可知溶液中n(NH ![]() )=0.012mol, C点溶液溶质为NaNO3 , 根据钠离子守恒n(NaNO3)=n(NaOH)=0.094L×2mol/L=0.188mol,根据氮原子守恒n原(HNO3)=n(NaNO3)+n(NH4+)=0.188mol+0.012mol=0.2mol,所以答案是:0.2.
)=0.012mol, C点溶液溶质为NaNO3 , 根据钠离子守恒n(NaNO3)=n(NaOH)=0.094L×2mol/L=0.188mol,根据氮原子守恒n原(HNO3)=n(NaNO3)+n(NH4+)=0.188mol+0.012mol=0.2mol,所以答案是:0.2.

【题目】下列用品的有效成分与用途对应有错误的是( )
A | B | C | D | |
用品 | 食盐 | 水玻璃 | 复方氢氧化铝片 | 84消毒液 |
有效成分 | NaCl | Na2SiO3 | Al(OH)3 | NaClO |
用途 | 做调味品 | 刻蚀玻璃 | 做抗酸药 | 做消毒剂 |
A. AB. BC. CD. D