题目内容
【题目】
氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合韧是目前所采用的主要储氢材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。在基态Ti中,价电子排布式为____,价电子排布图为____
(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H2![]() 2NH3,实现储氢和输氢。下列说法正确的是_____;
2NH3,实现储氢和输氢。下列说法正确的是_____;
a.NH3分子中氮原子的轨道杂化方式为sp2杂化
b.NH+4与PH+4、CH4、BH-4、ClO—4互为等电子体
c.相同压强时,NH3的沸点比PH3的沸点高
d.[Cu(NH3)4]2+离子中,N原子是配位原子
(3)用价层电子对互斥理论推断SnBr2分子中,Sn原子的轨道杂化方式为__________,
SnBr2分子中 Sn-Br的键角______120°(填“>”“<”或“=”)。
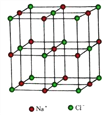
(4) NiO 的晶体结构与氯化钠相同, 在晶胞中镍离子的配位数是_______。
已知晶胞的边长为 a nm, NiO 的摩尔质量为 b g·mol-1, NA为阿伏加德罗常数的值, 则NiO 晶体的密度为_________g·cm-3。
【答案】 3d24S2 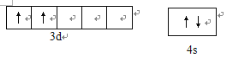 cd sp2杂化 < 6 4b×1021/(a3.NA)
cd sp2杂化 < 6 4b×1021/(a3.NA)
【解析】本题考查选修3《物质结构与性质》,(1)Ti位于第四周期IVB族,22号元素,Ti的价电子是最外层电子和次外层d能级,即价电子排布式为:3d24s2,电子排布图为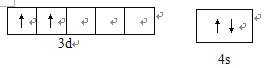 ;(2)a、NH3中N有3个σ键,孤电子对数为(5-3)/2=1,杂化类型为sp3,故错误;b、等电子体是原子总数相同,价电子总数相等微粒互为,原子总数相等,价电子总数分别是8、8、8、8、12,ClO4-与NH4+不是等电子体,故错误;c、NH3中存在分子间氢键,PH3不存在分子间氢键,因此NH3的沸点强于PH3,故正确;d、NH3中N存在孤电子对,Cu2+提供空轨道,因此N为配位原子,故正确;(3)Sn有2个σ键,孤电子对数=(4-2)/2=1,杂化类型为sp2,含有一个孤电子对,孤电子对-成键电子对之间的斥力大于成键原子-成键原子之间的斥力,因此Sn-Sn键角小于120°;(4)此化合物是离子化合物,配位数是异性离子的个数,因此Ni2+的配位数是6,Ni2+位于顶点和面心,因此Ni2+个数为8×1/8+6×1/2=4,晶胞的质量为
;(2)a、NH3中N有3个σ键,孤电子对数为(5-3)/2=1,杂化类型为sp3,故错误;b、等电子体是原子总数相同,价电子总数相等微粒互为,原子总数相等,价电子总数分别是8、8、8、8、12,ClO4-与NH4+不是等电子体,故错误;c、NH3中存在分子间氢键,PH3不存在分子间氢键,因此NH3的沸点强于PH3,故正确;d、NH3中N存在孤电子对,Cu2+提供空轨道,因此N为配位原子,故正确;(3)Sn有2个σ键,孤电子对数=(4-2)/2=1,杂化类型为sp2,含有一个孤电子对,孤电子对-成键电子对之间的斥力大于成键原子-成键原子之间的斥力,因此Sn-Sn键角小于120°;(4)此化合物是离子化合物,配位数是异性离子的个数,因此Ni2+的配位数是6,Ni2+位于顶点和面心,因此Ni2+个数为8×1/8+6×1/2=4,晶胞的质量为![]() g,晶胞的体积为(a×10-7)3cm3,根据密度的定义,晶胞的密度为4b×1021/(a3×NA) g·cm-3。
g,晶胞的体积为(a×10-7)3cm3,根据密度的定义,晶胞的密度为4b×1021/(a3×NA) g·cm-3。