题目内容
【题目】置换反应可表示为:
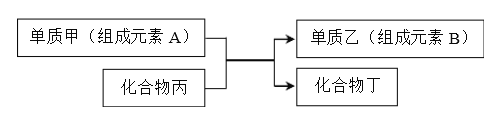
回答下列问题:
(1)下列物质能由化合反应制得,但不能由单质与酸发生置换反应得到的是__________。
A.AgCl B.FeCl2 C.AlCl3 D.FeCl3
(2)若A、B都是短周期元素,且B的原子序数是A两倍。则A在元素周期表中的位置
是_____________。
(3)若乙是一种常见半导体材料,工业上利用上述反应制取乙的化学方程式为____________。
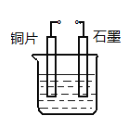
(4)若甲是Cu,乙是H2,某学生设计如图电化学装置实现该置换反应。则铜片为________极(填“正”、“ 负”、“ 阴”、“ 阳”),石墨上的电极反应______________。
(5)若甲是铝,丙是Fe3O4。过量的甲与丙完全反应后,欲从反应产物中分离出单质乙的化学方法是_______________。
(6)Cl2和NH3可发生置换反应。室温下,抽去下图所示装置中的玻璃片,使Cl2和NH3充分反应。
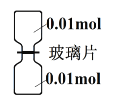
①NH3在___________瓶(填“上”或“下”) ;
②反应中,被氧化的B 元素与未被氧化的B 元素之比是_________;
③反应后取集气瓶壁附着的固体溶于适量水中,所得溶液中各离子浓度由大到小的顺序是____________。
【答案】 AD 第2周期ⅥA族 2C+SiO2![]() Si+2CO↑ 阳 2H++2e-=H2↑或 2H2O+2e-=H2↑+2OH- 加入足量的NaOH溶液充分反应后,过滤 下 2:1 c(Cl-)>c(NH4+)>c(H+)>c(OH-)
Si+2CO↑ 阳 2H++2e-=H2↑或 2H2O+2e-=H2↑+2OH- 加入足量的NaOH溶液充分反应后,过滤 下 2:1 c(Cl-)>c(NH4+)>c(H+)>c(OH-)
【解析】本题主要考查元素化合物。
(1)A.盐酸与不活泼金属银不发生置换反应;B. Fe+2HCl![]() FeCl2+H2↑;C. 2Al+6HCl
FeCl2+H2↑;C. 2Al+6HCl![]() 2AlCl3+3H2↑; D.铁与盐酸发生置换反应不能生成FeCl3。故选AD。
2AlCl3+3H2↑; D.铁与盐酸发生置换反应不能生成FeCl3。故选AD。
(2)若A、B都是短周期元素,且B的原子序数是A两倍,则A是氧,B是硫,A在元素周期表中的位置是第2周期ⅥA族。
(3)乙是一种常见半导体材料,所以乙是单质硅,工业上利用上述反应制取乙的化学方程式为SiO2 + 2C![]() Si + 2CO↑。
Si + 2CO↑。
(4)该置换反应为Cu+ 2H20![]() Cu(OH)2+H2↑,则铜片为阳极,石墨上的电极反应:2H++2e-=H2↑或 2H2O+2e-=H2↑+2OH-。
Cu(OH)2+H2↑,则铜片为阳极,石墨上的电极反应:2H++2e-=H2↑或 2H2O+2e-=H2↑+2OH-。
(5)反应产物中含有铝、氧化铝、铁,铝、氧化铝溶于氢氧化钠溶液,而铁不溶,所以欲从反应产物中分离出单质乙的化学方法是加入足量的NaOH溶液充分反应后,过滤。
(6)①为了使Cl2和NH3充分反应,NH3的密度小,所以在下瓶;
②B元素是氮,发生反应:3NH3+3Cl2![]() N2+5HCl+NH4Cl,可见反应中被氧化的B元素与未被氧化的B元素之比是2:1;
N2+5HCl+NH4Cl,可见反应中被氧化的B元素与未被氧化的B元素之比是2:1;
③集气瓶壁附着的固体是氯化铵,反应后取集气瓶壁附着的固体溶于适量水中形成氯化铵溶液,氯化铵水解使溶液呈酸性,所得溶液中各离子浓度由大到小的顺序是c(Cl-)>c(NH4+)>c(H+)>c(OH-)。


