题目内容
【题目】某实验小组同学探究铜与硝酸的反应。
(1)用浓硝酸和水按照不同体积比配成不同浓度的硝酸,各取10 mL硝酸分别与铜片反应,实验记录如下:
序号 | 浓硝酸与水 的体积比 | 实验现象 |
Ⅰ | 1∶1 | 反应速率快,溶液很快变成蓝色,铜丝表面有大量气泡冒出,气体呈红棕色 |
Ⅱ | 1∶3 | 反应速率较快,溶液变成蓝色,铜丝表面有大量气泡冒出,气体无色 |
Ⅲ | 1∶5 | 反应速率慢,微热后速率加快,溶液变成蓝色,铜丝表面有气泡冒出,气体无色 |
①铜与稀硝酸反应的离子方程式为______________;若生成标准状况下0.56 L NO气体,反应中被还原的HNO3的质量为________g(小数点后保留两位有效数字)。
②依据上表,制备NO气体最适宜的是实验Ⅱ,理由是_______________________。
(2)为防止有毒气体逸散造成空气污染,该小组同学改进实验装置,如图所示(夹持仪器略去)。
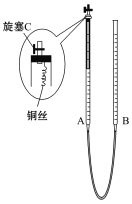
用该装置进行铜与稀硝酸的反应并验证产生NO气体的性质,实验步骤如下:
Ⅰ.安装好装置后,检查装置气密性。
Ⅱ.打开旋塞C,从B管上端加入所选浓度的硝酸,至铜丝下沿(不接触铜丝)。
Ⅲ.向上移动B管,使A管液面上升至与橡胶塞恰好接触,关闭旋塞C,反应开始。
Ⅳ.当液面重新下降至与铜丝脱离接触时,反应停止。
Ⅴ.打开旋塞C,移动B管,使A中迅速进入少量空气,关闭旋塞C,观察现象。
……
①步骤Ⅰ中检查装置气密性的操作是:关闭旋塞C,从B管上端加入水,若观察到____________________,说明装置的气密性良好。
②步骤Ⅲ操作的目的是_________________________________。
③为使A管内的NO气体完全被溶液吸收,可进一步采取的操作是__________________,能确定NO完全被溶液吸收的现象是____________________________。
【答案】(1)①3Cu+8H++2NO![]() ===3Cu2++2NO↑+4H2O 1.58
===3Cu2++2NO↑+4H2O 1.58
②产物是NO,反应速率较快且不用加热
(2)①A、B间形成液面差,且保持不变
②赶走液面上方空气,防止NO被空气中的O2氧化,以便观察生成气体的颜色
③重复步骤Ⅴ的操作(合理即可) 再次重复操作后气体不再变为红棕色
【解析】(1)①铜与稀硝酸反应的离子方程式为3Cu+8H+
+2NO![]() ===3Cu2++2NO↑+4H2O;观察反应方程式知,被还原的HNO3的物质的量n(HNO3)=n(NO)=0.56 L÷22.4 L·mol-1=0.025 mol,即m(被还原的HNO3)=0.025 mol×63 g·mol-1≈1.58 g。②制备NO气体最适宜的是实验Ⅱ,因为产物是NO,反应速率较快且不用加热。(2)①检查装置气密性的操作是:关闭旋塞C,从B管上端加入水,若观察到A、B间形成液面差,且保持不变,说明装置的气密性良好。②NO容易被空气中的氧气氧化,为了观察NO的颜色必须排干净装置中的空气,即步骤Ⅲ操作的目的是赶走液面上方空气,防止NO被空气中的O2氧化,以便观察生成气体的颜色。
===3Cu2++2NO↑+4H2O;观察反应方程式知,被还原的HNO3的物质的量n(HNO3)=n(NO)=0.56 L÷22.4 L·mol-1=0.025 mol,即m(被还原的HNO3)=0.025 mol×63 g·mol-1≈1.58 g。②制备NO气体最适宜的是实验Ⅱ,因为产物是NO,反应速率较快且不用加热。(2)①检查装置气密性的操作是:关闭旋塞C,从B管上端加入水,若观察到A、B间形成液面差,且保持不变,说明装置的气密性良好。②NO容易被空气中的氧气氧化,为了观察NO的颜色必须排干净装置中的空气,即步骤Ⅲ操作的目的是赶走液面上方空气,防止NO被空气中的O2氧化,以便观察生成气体的颜色。

 名校课堂系列答案
名校课堂系列答案