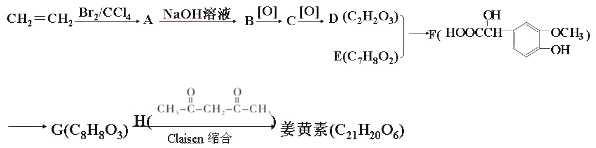
题目内容
【题目】下列说法中正确的是( )
①NaHCO3溶液加水稀释时,c(Na+)/c(HCO3-)将增大;
②浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混溶液:2c(Na+)=3[c(CO![]() )+c(HCO
)+c(HCO![]() )];
)];
③在0.1 mol·L—1氨水中滴加0.1 mol·L-1盐酸,恰好完全中和时pH=a,则由水电离产生的c(OH-)=10-amol·L-1;
④已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2Cr2O4)=2.0×10-12,则Ag2Cr2O4的溶解度小于AgCl
A. ①② B. ②④ C. ① D. ③④
【答案】C
【解析】①NaHCO3溶液中有HCO3-![]() H++ CO32-电离平衡存在,NaHCO3溶液加水稀释时,电离平衡向右移动,c(HCO3-)的减小的程度大,所以c(Na+)/c(HCO3-)将增大,①正确;②浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混溶液中,存在电荷守恒,2c(Na+)=3[c(CO
H++ CO32-电离平衡存在,NaHCO3溶液加水稀释时,电离平衡向右移动,c(HCO3-)的减小的程度大,所以c(Na+)/c(HCO3-)将增大,①正确;②浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混溶液中,存在电荷守恒,2c(Na+)=3[c(CO![]() )+c(HCO
)+c(HCO![]() )+ c(H2CO3],②不正确;③在0.1 mol·L—1氨水中滴加0.1 mol·L-1盐酸,恰好完全中和时得到氯化铵溶液,氯化铵水解使溶液呈酸性,pH=a时,c(H+)=
)+ c(H2CO3],②不正确;③在0.1 mol·L—1氨水中滴加0.1 mol·L-1盐酸,恰好完全中和时得到氯化铵溶液,氯化铵水解使溶液呈酸性,pH=a时,c(H+)=![]() mol/L,溶液中的OH-全部来自水的电离,依据水的离子积可以求出由水电离产生的c(OH-)=
mol/L,溶液中的OH-全部来自水的电离,依据水的离子积可以求出由水电离产生的c(OH-)=![]() =10a-14mol·L-1,③不正确;④Ksp(AgCl)=c(Ag+)c(Cl-)=1.8×10-10,则在氯化银的饱和溶液中c(Cl-)= c(Ag+)=
=10a-14mol·L-1,③不正确;④Ksp(AgCl)=c(Ag+)c(Cl-)=1.8×10-10,则在氯化银的饱和溶液中c(Cl-)= c(Ag+)=![]() =
=![]() mol/L,由此可以计算出在0.1L (约为100g水)溶液中大约可溶解氯化银的质量为0.1
mol/L,由此可以计算出在0.1L (约为100g水)溶液中大约可溶解氯化银的质量为0.1![]() ;Ksp(Ag2Cr2O4)=
;Ksp(Ag2Cr2O4)=![]() =2.0×10-12,在Ag2Cr2O4的饱和溶液中
=2.0×10-12,在Ag2Cr2O4的饱和溶液中![]() c(Cr2O42-),所以c(Cr2O42-)=
c(Cr2O42-),所以c(Cr2O42-)=![]() mol/L,Ag2Cr2O4的溶解度约为0.1
mol/L,Ag2Cr2O4的溶解度约为0.1![]() ,所以Ag2Cr2O4的溶解度大于AgCl,④不正确。综上所述,只有①正确,本题选C。
,所以Ag2Cr2O4的溶解度大于AgCl,④不正确。综上所述,只有①正确,本题选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案