题目内容
下列说法正确的是
| A.100℃时,KW =10-12,此温度下PH =6的溶液一定显酸性 |
| B.25℃时,0.1mol/L的NaHSO3溶液pH =4,说明HSO3-在水溶液中只存在电离 |
| C.NH4Cl、CH3COONa、NaHCO3、NaHSO4溶于水,对水的电离都有促进作用 |
| D.25℃时,10mL 0.1mol/L CH3COOH溶液与5mL 0.1mol/L NaOH溶液混合,所得溶液中有 |
D
解析试题分析:A、100℃时,KW =10-12,则c(H+)=c(OH-)=10-6,所以PH =6的溶液一定显中性,错误;B、25℃时,0.1mol/L的NaHSO3溶液pH =4,不能说明HSO3-在水溶液中只存在电离。亚硫酸是弱酸,HSO3-既电离又水解,但电离程度大于水解程度,所以溶液显酸性,错误;C、NaHSO4在水中完全电离产生氢离子、钠离子、硫酸根离子,对水的电离有抑制作用,错误;D、25℃时,10mL 0.1mol/L CH3COOH溶液与5mL 0.1mol/L NaOH溶液混合,根据溶液中的物料守恒,得2c(Na+)= c(CH3COO-) + c(CH3COOH),正确,答案选D。
考点:考查溶液的酸碱性的判断,水解和电离的比较,对水电离的影响,守恒规律的应用

 阅读快车系列答案
阅读快车系列答案已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1)CuSO4+Na2CO3:Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑
(2)CuSO4+Na2S: Cu2++S2-=CuS↓
下列几种物质的溶解度大小的比较中,正确的是
| A.CuS<Cu(OH)2<CuCO3 | B.CuCO3<Cu(OH)2<CuS |
| C.CuS<CuCO3<Cu(OH)2 | D.Cu(OH)2<CuCO3<CuS |
下列说法正确的是( )
| A.NaHCO3溶液加水稀释,c(Na+)/c(HCO3-)的比值保持增大 |
| B.浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c(CO32-)+c(HCO3-)] |
| C.在高锰酸钾溶液中,H+、K+、SO42-、葡萄糖分子可以大量共存 |
| D.已知:Ksp(AgCl)=1.8×10-10, Ksp(Ag2Cr2O4)=2.0×10-12,则Ag2CrO4的溶解度小于AgCl |
常温时,下列各溶液中有关粒子浓度的说法正确的是( )
| A.pH=5的NaHSO3溶液:c(HSO3-) > c(SO32-)> c(H2SO3) |
| B.pH=3的盐酸跟pH=11的氨水等体积混合: c(H+)>c(OH-) |
| C.pH<7的CH3COONa和CH3COOH的混合溶液 c(Na+)> c(CH3COO-)> c(H+)>c(OH-) |
| D.pH=12的NaOH溶液中:c(OH-)水电离=1.0×10-12 mol/L |
对100mL 1mol·L-1的Na2CO3溶液,下列说法不正确的是
A.将溶液稀释,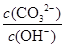 减少 减少 |
| B.滴人含0.l mol CH3COOH的溶液:c ( CH3 COO一)<c( HCO3一) |
| C.通人0.1 mo1CO2气体,溶液中存在:c ( Na+)=c( CO32一)十c( HCO3一)+c(H2CO3) |
| D.滴人酚酞,微热,溶液颜色加深 |
室温下,用0.100 mol/L NaOH 溶液分别滴定20.00 mL 0.100 mol/L的盐酸和醋酸,
下列说法正确的是
| A.起始时盐酸和醋酸溶液PH相同 |
B.V(NaOH)="10.00" mL 时,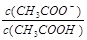 <1 <1 |
| C.pH=7时,两种酸所用NaOH溶液体积不相等,醋酸用的体积多 |
| D.V(NaOH)="20" .00 mL 时,c(Cl?)>c(CH3COO—) |
硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下,下列说法正确的是( )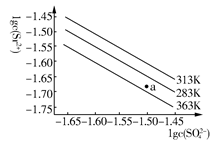
| A.温度一定时,Ksp(SrSO4)随c(SO42—)的增大而减小 |
| B.三个不同温度中,313 K时Ksp(SrSO4)最大 |
| C.283 K时,图中a点对应的溶液是饱和溶液 |
| D.283 K下的SrSO4饱和溶液升温到363 K后变为不饱和溶液 |
已知温度T时水的离子积常数为KW,该温度下,将浓度为a mol·L-1的一元酸HA与b mol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是 ( )
| A.a=b |
| B.混合溶液的pH=7 |
C.混合溶液中,c(H+)= mol·L-1 mol·L-1 |
| D.混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-) |
能说明醋酸是弱电解质的是
| A.中和10mL 1mol/L CH3COOH溶液需要10ml 1mol/L NaOH溶液 |
| B.用食醋可以除热水瓶内的水垢 |
| C.pH=2的醋酸溶液稀释1000倍后pH小于5 |
| D.用浓H2SO4和醋酸钠固体共热可制得醋酸 |