题目内容
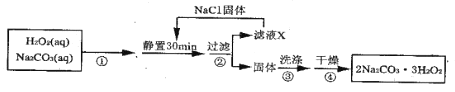
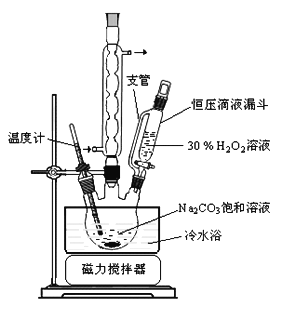
【题目】过碳酸钠(![]() )是一种集洗涤、漂白、杀菌于一体的氧系漂白剂。某兴趣小组制备过碳酸钠的实验方案和装置示意图如下:
)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂。某兴趣小组制备过碳酸钠的实验方案和装置示意图如下:
已知主反应:![]()
![]()
![]() H<0
H<0
副反应:![]() 50℃时
50℃时![]() 开始分解
开始分解
请回答下列问题:
(1)步骤①的关键是_____________,其原因是______________________。
(2)在滤液X中加入适量NaCl固体的目的是________________________。
(3)步骤③中选用无水乙醇洗涤产品的目的是_______________________。
(4)下列物质中,会引起过碳酸钠失效的有____________。
A.![]() B.
B.![]() C.
C.![]() D.HCl
D.HCl
(5)过碳酸钠的产品中往往含有少量碳酸钠,可用重量法测定过碳酸钠的质量分数;其操作步骤:取样品溶液→加入![]() 溶液→过滤→洗涤→干燥→称重。需直接测定的物理量有:样品的质量
溶液→过滤→洗涤→干燥→称重。需直接测定的物理量有:样品的质量![]() g,沉淀的质量
g,沉淀的质量![]() g,则产品中过碳酸钠质量分数的表达式为:___________。
g,则产品中过碳酸钠质量分数的表达式为:___________。
【答案】 控制反应温度不能超过50℃ 制备过碳酸钠是放热反应,防止H2O2和过碳酸钠分解 增大钠离子浓度,有利于过碳酸钠的析出,提高产率,减少损失 减少过碳酸钠的溶解损失,并带走水分利于干燥 BD 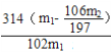
【解析】试题分析:本题考查过碳酸钠的制备实验,涉及实验条件的控制和实验试剂的作用,过碳酸钠的性质,定量实验的计算。
(1)根据题给已知:Na2CO3与H2O2生成过碳酸钠的反应为放热反应,H2O2会发生分解反应,50℃时2Na2CO3·3H2O2(s)开始分解,所以步骤①的关键是控制反应温度不能超过50℃,原因是制备过碳酸钠是放热反应,防止H2O2和过碳酸钠分解。
(2)在滤液X中加入适量NaCl固体的目的是:NaCl电离出Na+,增大Na+浓度,降低过碳酸钠的溶解度(盐析作用),有利于过碳酸钠析出,提高过碳酸钠的产率,减少损失。
(3)由于乙醇与水互溶,乙醇沸点低易挥发,过碳酸钠在乙醇中溶解度小,步骤③选用无水乙醇洗涤产品的目的是:减少过碳酸钠的溶解损失,带走水分,利于干燥。
(4)A,NaHCO3与过碳酸钠不反应,不会引起过碳酸钠失效;B,Na2SO3具有还原性,过碳酸钠具有氧化性,发生反应3Na2SO3+2Na2CO3·3H2O2=3Na2SO4+2Na2CO3+3H2O,会引起过碳酸钠失效;C,Na2SiO3与过碳酸钠不反应,不会引起过碳酸钠失效;D,HCl与过碳酸钠发生反应,引起过碳酸钠失效;会引起过碳酸钠失效的是Na2SO3、HCl,答案选BD。
(5)n(BaCO3)总=![]() mol,则n(Na2CO3)总=
mol,则n(Na2CO3)总=![]() mol,m(Na2CO3)总=
mol,m(Na2CO3)总=![]() mol
mol![]() 106g/mol=
106g/mol=![]() g,m(H2O2)=(m1-
g,m(H2O2)=(m1-![]() )g,n(H2O2)=(m1-
)g,n(H2O2)=(m1-![]() )g
)g![]() 34g/mol=
34g/mol= mol;n(2Na2CO3·3H2O2)=
mol;n(2Na2CO3·3H2O2)=![]() n(H2O2)=
n(H2O2)=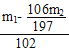 mol,m(2Na2CO3·3H2O2)= n(2Na2CO3·3H2O2)
mol,m(2Na2CO3·3H2O2)= n(2Na2CO3·3H2O2)![]() 314g/mol=
314g/mol=g,产品中过碳酸钠的质量分数为
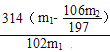 。
。

【题目】下列实验操作、现象和得出的结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 向某溶液中滴入几滴酸性KMnO4溶液,然后滴加KSCN溶液 | 溶液最终变为红色 | 原溶液中含有 |
B | 向浓度均为0.1mol·L-1NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 |
|
C | 用洁净的铂丝蘸取某溶液,在酒精灯火焰上灼烧 | 透过蓝色钴玻璃观察到火焰焰色为紫色 | 原溶液中一定只含 |
D | 在试管中取少量淀粉,加入稀硫酸后加热片刻,冷却后取澄清液滴入新制的Cu(OH)2加热煮沸 | 未见砖红色沉淀生成 | 淀粉未发生水解 |
A. A B. B C. C D. D