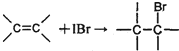题目内容
某一研究性学习小组做了以下实验:在溴水中加入足量乙醛溶液,观察到溴水
褪色现象。
【提出问题】 产生上述现象的原因是什么?
【提出猜想】
①溴水可能与乙醛发生取代反应
② ;
③ 。
【设计方案】
方案一:检验褪色后溶液的酸碱性
方案二:测定反应前溴水中Br2的物质的量和反应后Br-离子的物质的量
【实验探究】
按物质的量之比为 1∶5 配制 1000mL KBrO3—KBr溶液,该溶液在酸性条件下完全反
应可生成0.5mol Br2。取该溶液10 mL,加入足量乙醛溶液使其褪色,然后将所得溶液稀
释为100 mL,准确量取其中的10 mL,加入过量AgNO3溶液,过滤、洗涤、干燥后称量
得到固体0.188g。
【解释与结论】
(1)假设测得反应前溴水中Br2的物质的量为a mol,
①若测得反应后n(Br-)= 0 mol,则说明溴水与乙醛发生了 反应;
②若测得反应后n(Br-)= a mol, 则说明溴水与乙醛发生了 反应;
③若测得反应后n(Br-)= 2a mol,则说明溴水使乙醛发生了 反应。
(2)若已知CH3COOAg易溶解于水,试通过计算判断溴水与乙醛发生反应的类型为:
反应的类型为: __________________; 理由是:___________________________ ;
其反应方程式为:_________________________________________________________。
【反思与评价】
方案一是否可行?_____________;理由是______________________________________.
【提出猜想】②加成 (1分) ③氧化 (1分)
【解释与结论】(1)①加成反应;②取代反应;③氧化反应 (共3分)
(2)氧化反应 (1分) 由实验数据计算得参加反应的n(Br2)==0.0005mol,
生成的n(AgBr)===0.001mol,即n(Br-)===2n(Br2),说明溴水与乙醛发生氧化反应 (2分)
CH3CHO+Br2+H2O→CH3COOH+2HBr (2分)
【反思与评价】不可行 (1分)取代反应、氧化反应都使溶液的酸性增强 (1分)