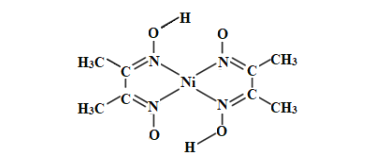
题目内容
【题目】E是合成某药物的中间体,其一种合成路线如图:

(1)A中含氧官能团的名称是___。
(2)A→B的反应条件和试剂是___。
(3)D→E的反应类型是___。
(4)写出B→C的化学方程式___。
(5)E的分子式为___。
(6)B的环上二溴代物有___种(不考虑立体异构)。
【答案】羟基 O2/Cu,加热 取代(酯化)反应 ![]() +NaOH
+NaOH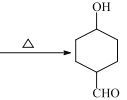 +NaCl C8H12O3 11
+NaCl C8H12O3 11
【解析】
(1)根据A的结构简式可知A的含氧官能团为羟基;
(2)A到B为羟基的催化氧化,反应条件为:O2/Cu,加热;
(3)D到E为羧基和羟基的酯化反应(取代反应);
(4)B到C为卤代烃的取代反应,方程式为:![]() +NaOH
+NaOH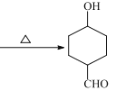 +NaCl;
+NaCl;
(5)根据E的结构简式可知E的分子式为C8H12O3;
(6)当两个氯原子在同一个碳上时有如图 两种结构,当两个氯原子在不同碳上时可采用定一移一的方法分析,有
两种结构,当两个氯原子在不同碳上时可采用定一移一的方法分析,有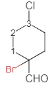 、
、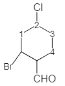 、
、 ,共2+3+4+2=11种。
,共2+3+4+2=11种。

【题目】已知常温下部分弱电解质的电离平衡常数如下表:
化学式 | HF | HClO | H2CO3 | NH3·H2O |
电离常数 | 6.8×104 | 4.7×108 | K1=4.3×107 K2=5.6×1011 | Kb=1.7×105 |
(1)常温下,物质的量溶度相同的三种溶液①NaF溶液 ②NaClO溶液 ③Na2CO3溶液,其PH由大到小的顺序是___________(填序号)
(2)25°C时,PH=4的NH4Cl溶液中各离子浓度的大小关系为___________________
(3)NaClO溶液中的电荷守恒关系为_________________
(4)向NaClO溶液中通入少量的CO2,所发生的离子方程式为_________
(5)常温下,0.1mol/L的氨水和0.1mol/L的NH4Cl溶液等体积混合,判断混合溶液的酸碱性____________(填“酸性”“碱性”“中性”)
【题目】天然气是一种清洁能源和重要化工原料。
(1)下列事实能说明CH4分子呈正四面体结构的是___(填字母)。
A.CH4分子的4个C—H共价键键长相等
B.CH4分子中每个键角都是109°28′
C.CH2F2没有同分异构体
D.CCl4的沸点高于CH4的
(2)甲烷与下列烃的通式相同的是___(填字母)。

(3)已知断裂几种化学键要吸收的能量如下:
化学键 | C—H | O=O | C=O | H—O |
断裂1mol键吸收的能量/kJ | 415 | 497 | 745 | 463 |
16gCH4在O2中完全燃烧生成气态CO2和气态水时___(填吸收”或放出”)约___ kJ热量。
(4)天然气/空气燃料电池中,若KOH为电解质,负极反应式为___。等质量的甲烷分别以稀硫酸、KOH溶液为电解质溶液完全放电时,理论上提供的电能之比为___。
【题目】中国科学院大连化学物理研究所的“甲醇制取低碳烯经(![]() 技术”获得国家科学技术发明一等奖,该技术先由煤气化制合成气再由合成气制甲醇和氨气,最后由甲醇制乙烯和丙烯。
技术”获得国家科学技术发明一等奖,该技术先由煤气化制合成气再由合成气制甲醇和氨气,最后由甲醇制乙烯和丙烯。
(1)煤气化包含一系列化学反应,已知热化学方程式:
![]()
![]()
![]()
![]()
则反应![]()
![]() _____
_____![]()
(2)以投料比![]() 合成甲醇:
合成甲醇:![]() ,温度、压强与
,温度、压强与![]() 的平衡转化率的关系如图所示
的平衡转化率的关系如图所示

回答下列问题:
①![]() _____(填>”或“<)0
_____(填>”或“<)0
②![]() ______(填“>“或“<”)
______(填“>“或“<”)![]()
③![]() ,
,![]() 时,
时,![]() 点的
点的![]() _____(填>”或"<")
_____(填>”或"<")![]() 。
。
④若起始时提高投料比![]() 的平衡转化率将_______(填”増大”或“减小”)。
的平衡转化率将_______(填”増大”或“减小”)。
⑤参照下表,实际工业生产中大多采用![]() 和
和![]() ,其优点是____________。
,其优点是____________。
span>方法 | 催化剂 | 条件 | 备注 | 特点 | |
压力 | 温度 | ||||
高压法 |
二元催化剂 | 25~30 | 380~400 | 1924年工业化 | (1)催化剂不易中毒,再生困难 (2)副反应多 |
低压法 |
三元催化剂 | 5 | 230~270 | 1966年工业化 | (1)催化剂易中毒,再生容易,寿命为1~2年 (2)副反应少 |
(3)![]() 和
和![]() 生成
生成![]() 的反应为
的反应为![]()
![]() ,在
,在![]() 催化剂作用下的反应历程如下(
催化剂作用下的反应历程如下(![]() 表示吸附态)
表示吸附态)
化学吸附:![]() ;
;![]()
表面反应![]() ;
;![]() ,
,![]()
脱附:![]()
其中,![]() 的吸附分解反应活化能高,速率慢,决定了合成氨的整体反应速率.
的吸附分解反应活化能高,速率慢,决定了合成氨的整体反应速率.
①有利于提高合成氨平衡产率的条件有______(填字母)
A 低温 B 高温 C 低压 D 高压 E 催化剂
②标准平衡常数![]() =
=![]() ,其中
,其中![]() 为标准压强(
为标准压强(![]() ),
),![]() 、
、![]() 和
和![]() 为各组分的平衡分压,如
为各组分的平衡分压,如![]() ,
,![]() 为平衡总压,
为平衡总压,![]() 为平衡系统中
为平衡系统中![]() 的物质的量分数.已知起始时向一密闭容器中投入
的物质的量分数.已知起始时向一密闭容器中投入![]()
![]() 和
和![]()
![]() ,反应
,反应![]()
![]() +
+![]()
![]()
![]()
![]() 在恒定温度和标准压强下进行,
在恒定温度和标准压强下进行,![]() 的平衡产率为
的平衡产率为![]() ,则该反应的
,则该反应的![]() =________(用含
=________(用含![]() 的代数式表示)。下图中可以表示标准平衡常数随温度
的代数式表示)。下图中可以表示标准平衡常数随温度![]() 的变化趋势的是____________(填字母)
的变化趋势的是____________(填字母)