题目内容
【题目】利用反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)+Q(Q>0)可处理NO2、SO2等大气污染物,具有十分重要的意义。
SO3(g)+NO(g)+Q(Q>0)可处理NO2、SO2等大气污染物,具有十分重要的意义。
完成下列填空。
(1)该反应中被氧化的元素是_____;写出该反应的平衡常数表达式:K=_____。
(2)若将NO2(g)和SO2(g)置于一密闭容器中进行上述反应。下列说法能表明反应达到平衡状态的是______(选填编号)。
a.混合气体颜色保持不变 b.NO2和NO的体积比保持不变
c.每消耗1mol SO2的同时生成1mol SO3 d.体系中气体密度保持不变
(3)一定温度下,在容积为V L的容器中发生上述反应,t min内,SO2的物质的量下降了a mol,则这段时间内v(NO)=_______(用相关字母表示并注明单位)。
(4)请写出两种能提高SO2转化率的措施:_________。
(5)亚硫酸溶液久置,pH会变小,请用化学方程式表示其原因___。
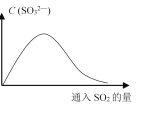
(6)将SO2持续通入NaOH溶液中,溶液中SO32-的浓度变化如图所示,请解释原因。__________。
【答案】SO2中+4价的S ![]() ab
ab ![]() mol/(L·min) 通入NO2、移走NO或SO3、降低温度、通入O2等(任写两种) 2H2SO3 +O2=2H2SO4 SO2与OH-反应生成SO32-,因此SO32-浓度增大;继续通入SO2时,SO2与SO32-反应生成HSO32-,导致SO32-浓度减小
mol/(L·min) 通入NO2、移走NO或SO3、降低温度、通入O2等(任写两种) 2H2SO3 +O2=2H2SO4 SO2与OH-反应生成SO32-,因此SO32-浓度增大;继续通入SO2时,SO2与SO32-反应生成HSO32-,导致SO32-浓度减小
【解析】
(1)氧化还原反应中所含元素化合价升高被氧化、化合价降低被还原;化学反应的平衡常数K=![]() ;
;
(2)平衡标志是用同一物质表示的正、逆反应速率相同,各成分浓度保持不变;
(3)同一反应,不同反应物或生成物的速率之比等于化学计量数之比,且v=![]() ;
;
(4)可结合影响平衡的因素分析,通过改变影响平衡的条件,促进平衡正向移动,提高SO2的转化率;
(5)亚硫酸具有较强还原性,易被空气中的氧气氧化生成硫酸,硫酸为强酸,由此分析放置亚硫酸pH变小的原因;
(6)SO2溶于NaOH溶液生成Na2SO3,随着反应的进行,溶液中SO32-增大,当NaOH完全反应后,继续通入SO2,Na2SO3会与SO2反应生成NaHSO3,溶液中SO32-浓度降低。
(1)反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)中S元素化合价从反应前SO2的+4升高为SO3的+6,被氧化;根据平衡常数的含义可知此反应的平衡常数表达式:K=
SO3(g)+NO(g)中S元素化合价从反应前SO2的+4升高为SO3的+6,被氧化;根据平衡常数的含义可知此反应的平衡常数表达式:K=![]() ;
;
(2)a.平衡混合物中只有NO2是红棕色的气体,其它气体均无色,若混合气体颜色保持不变, 则NO2浓度不变,证明反应达到平衡状态,a正确;
b.在反应过程中NO2和NO的体积之比为变量,则当NO2和NO的体积之比保持不变,能说明反应达到平衡,b正确;
c.每消耗1mol SO2的同时生成1mol SO3,说明反应正向进行,不能证明反应达到平衡,c错误;
d.反应前后气体质量不变,气体的体积不变,则反应过程中体系的气体密度始终不变,因此体系气体密度不变不能证明反应达到平衡,d错误;
故合理选项是ab;
(3)一定温度下,在容积为V L的容器中发生上述反应,t min内,SO2的物质的量下降了a mol,则这段时间内v(SO2)=![]() mol/(L·min);
mol/(L·min);
(4)此反应的正反应为吸热反应,根据平衡移动原理,通入NO2、移或通入O2、走NO或SO3、降低温度均能促进平衡正向移动,达到提高SO2的转化率目的;
(5)亚硫酸为弱酸,但其还原性较强,易被空气中氧化氧化,发生2H2SO3+O2=2H2SO4,生成的硫酸为强酸,强酸完全电离产生自由移动的离子,因此可使溶液酸性增强,使pH减小;
(6)在NaOH溶液中不断通SO2,开始时SO2与OH-反应生成SO32-,使溶液中SO32-浓度增大;随着反应的进行,当通入SO2过量时,H2O、SO2与SO32-反应生成HSO3-,导致SO32-浓度又逐渐减小。

【题目】元素是构成我们生活的世界中一切物质的“原材料”。
Ⅰ.1869年,门捷列夫在前人研究的基础上制出了第一张元素周期表,如图所示。
Ni=Co=59 | |||||
H=1 | Cu=63.4 | Ag=108 | Hg=200 | ||
Be=9.4 | Mg=24 | Zn=65.2 | Cd=112 | ||
B=11 | Al=27.4 | ?=68 | Ur=116 | Au=198? | |
C=12 | Si=28 | ?=70 | Sn=118 | ||
N=14 | P=31 | As=75 | Sb=122 | Bi=210? | |
O=16 | S=32 | Se=79.4 | Te=128? | ||
F=19 | Cl=35.5 | Br=80 | I=127 | ||
Li=7 | Na=23 | K=39 | Rb=85.4 | Cs=133 | Tl=204 |
Ca=40 | Pb=207 |
(1)门捷列夫将已有元素按照相对原子质量排序,同一___(填“横行”或“纵列”)元素性质相似。
(2)结合表中信息,猜想第5列方框中“Te=128?”的问号表达的含义是___。
Ⅱ.X、Y、Z、W是现在元素周期表中的短周期元素,它们的相对位置如图所示,其中Y元素原子核外最外层电子数是其电子层数的3倍。
X | Y | |
Z | W |
请回答下列问题:
(1)W位于周期表中的位置__。W的原子核外电子运动状态有___种,原子轨道数为___。
(2)比较Y、Z气态氢化物的稳定性___(用分子式表示)。
(3)科学家们认为存在含氢量最高的化合物XH5,预测其与水剧烈反应放出气体,所得水溶液呈弱碱性,写出该反应的化学方程式___,XH5是离子化合物,它的电子式为___。
(4)工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,写出Z2W2与水反应的化学方程式___。
【题目】下列实验现象描述错误的是
编号 | 实验 | 现象 |
A | 加热放在坩埚中的小块钠 | 钠先熔化成光亮的小球,燃烧时,火焰为黄色,燃烧后,生成淡黄色固体 |
B | 在酒精灯上加热用砂纸打磨过的铝箔 | 铝箔变软,失去光泽,熔化的铝并不滴落 |
C | 在FeCl2溶液中滴入NaOH溶液 | 生成白色沉淀,沉淀很快变为灰绿色,最后变为红褐色 |
D | 将水蒸气通过灼热的铁粉 | 黑色粉末变为红褐色 |
A. A B. B C. C D. D