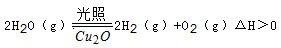题目内容
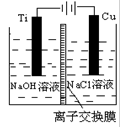
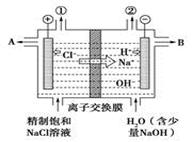
以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下:
下列说法不正确的是

下列说法不正确的是

A.在阴极式,发生的电极反应为:2H2O+2e- 2OH―+H2↑ 2OH―+H2↑ |
B.在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2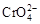 +2H+ +2H+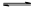 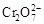 +H2O向右移动 +H2O向右移动 |
C.该制备过程总反应的化学方程式为:4K2CrO4+4H2O 2K2Cr2O7+4KOH+2H2↑+2O2↑ 2K2Cr2O7+4KOH+2H2↑+2O2↑ |
D.测定阳极液中K和Cr的含量,若K与Cr的物质的量之比为d,则此时铬酸钾的转化率为α=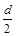 |
D
本题是电解法在制备物质中的具体应用。分析该制备时,重点要把握其中的K2CrO4在转变为K2Cr2O7的过程中没有发生化合价的变化,所以要抓住是由于溶液的pH变化实现目标物的合成,制备的过程是通过电解的方法改变溶液的pH来实现。阴极的反应是 2H2O+2e-=2OH-+H2,阳极为2H2O-4e-=O2+4H+,电解过程中阳极区的c(H+)增大,促进平衡2CrO42-+2H+= Cr2O72-+H2O向右移动,总反应为4 K2CrO4+4H2O=2 K2Cr2O7+4KOH+2H2↑+O2↑;若设加入反应容器内的K2CrO4有1mol,反应中有x mol K2CrO4转化为K2Cr2O7,则阳极区剩余的K2CrO4为(1-x) mol,对应的n(K)="2(1-x)" mol,n(Cr)=" (1-x)" mol,生成的K2Cr2O7为x/2 mol,,对应的n(K)=" x" mol,n(Cr)=" x" mol,由n(K)/ n(Cr)=d可得,x=2-d,转化率为(2-d)/1。
【考点定位】本题通过制备重铬酸钾考查电化学知识。
【考点定位】本题通过制备重铬酸钾考查电化学知识。

练习册系列答案
相关题目
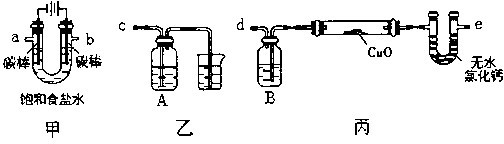
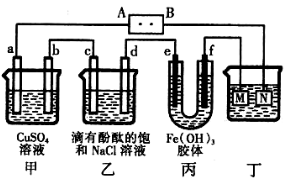
 Cu2O + H2↑。
Cu2O + H2↑。