题目内容
下列说法中正确的是 ( )
| A.6.8 g固体KHSO4与3.9 g固体Na2O2中阴离子数目相同 |
| B.常温下铁、铜均不溶于浓硫酸, 说明常温下铁、铜与浓硫酸均不反应 |
| C.离子化合物中只含离子键 |
| D.中子数为18的氯原子可表示为18Cl |
A
试题分析:KHSO4=K++HSO4-。n(KHSO4)="0.05" mol.所以n(HSO4-)="0.05" mol; Na2O2=2Na++O22-.n(Na2O2)=" 0.05" mol,所以所以n(O22-)="0.05" mol;因此阴离子数目相同。正确。B.常温下铁不溶于浓硫酸,是因为Fe在常温下在浓硫酸中会被氧化产生一层致密的氧化物保护膜,阻止了反应的继续减小,而铜不溶于浓硫酸是因为没有达到铜与浓硫酸反应所需要的温度。原因不同。错误。C.离子化合物中一定含离子键,可能含有共价键。如NaOH含有离子键、减小共价键。错误。D.中子数为18的氯原子可表示为
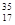 Cl.错误.
Cl.错误.
练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
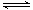 NO + SO3,在体积为VL的密闭容器中通入amolNO2和bmolSO2,反应后容器内硫原子和氧原子的个数比为( )
NO + SO3,在体积为VL的密闭容器中通入amolNO2和bmolSO2,反应后容器内硫原子和氧原子的个数比为( )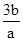
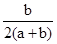
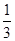
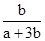
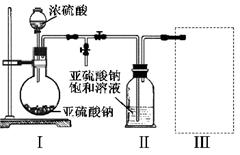
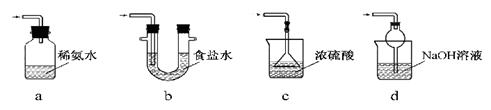

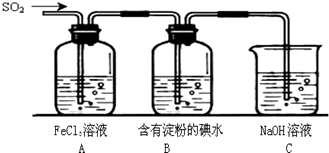
 Fe2O3+SO2↑+SO3↑,若将生成的气体通入氯化钡溶液中,得到的沉淀物是( )
Fe2O3+SO2↑+SO3↑,若将生成的气体通入氯化钡溶液中,得到的沉淀物是( )