题目内容
【题目】苯乙烷(![]() -C2H5)可生产塑料单体苯乙烯(
-C2H5)可生产塑料单体苯乙烯(![]() -CH=CH2),其原理反应是:
-CH=CH2),其原理反应是:![]() -C2H5(g)
-C2H5(g) ![]()
![]() -CH=CH2(g) + H2(g);△H = +125 kJ·mol-1。某温度下,将0.40 mol
-CH=CH2(g) + H2(g);△H = +125 kJ·mol-1。某温度下,将0.40 mol![]() -C2H5(g)充入2L真空密闭容器中发生反应,测定该容器内的物质,得到数据如下表:
-C2H5(g)充入2L真空密闭容器中发生反应,测定该容器内的物质,得到数据如下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n( | 0.40 | 0.30 | 0.26 | n2 | n3 |
n( | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
(1)n1=__________mol,计算该反应的平衡常数,K=___________。
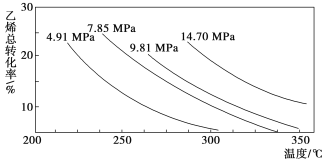
(2)工业上常以高温水蒸气作为反应体系的稀释剂(不参与反应)。![]() -C2H5(g)的平衡转化率与水蒸气的用量、体系总压强的关系如图所示。当其它条件不变时,水蒸气的用量越大,平衡转化率将_________(填“越大”、“越小”或“不变”),原因是____________。
-C2H5(g)的平衡转化率与水蒸气的用量、体系总压强的关系如图所示。当其它条件不变时,水蒸气的用量越大,平衡转化率将_________(填“越大”、“越小”或“不变”),原因是____________。

(3)副产物H2用做氢氧燃料电池。写出酸性条件下,该电池正极的电极反应式__________。
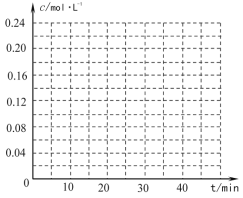
(4)在相同条件下,若最初向该容器中充入![]() -CH=CH2(g)和H2(g),假设在40min时达到上述同样的平衡状态,请在图中画出并标明该条件下
-CH=CH2(g)和H2(g),假设在40min时达到上述同样的平衡状态,请在图中画出并标明该条件下![]() -C2H5(g)和
-C2H5(g)和![]() -CH=CH2(g)的浓度c随时间t变化的曲线_____。
-CH=CH2(g)的浓度c随时间t变化的曲线_____。
【答案】 0.14 0.053 mol·L-1 越大 体系总压强一定时,水蒸气的分压越大,平衡体系的分压越小,平衡向气体体积增大的方向移动。或者:水蒸汽的用量增大,体系内各物质的浓度商QC小于平衡常数KC,所以平衡将向右移动,使苯乙烷的转化率增大 O2+ 4H+ + 4e- = 2H2O 
【解析】
(1)20min时,![]() -C2H5的物质的量为0.26mol,变化的物质的量为0.40mol-0.26mol=0.14mol,根据方程式
-C2H5的物质的量为0.26mol,变化的物质的量为0.40mol-0.26mol=0.14mol,根据方程式![]() -C2H5(g)
-C2H5(g)![]()
![]() -CH=CH2(g)+H2(g)可知,生成
-CH=CH2(g)+H2(g)可知,生成![]() -CH=CH20.14mol,
-CH=CH20.14mol,
![]() -C2H5(g)
-C2H5(g)![]()
![]() -CH=CH2(g)+H2(g)
-CH=CH2(g)+H2(g)
起始:0.40mol 0 0
转化:0.16mol 0.16mol 0.16mol
平衡:0.24mol 0.16mol 0.16mol
平衡时:c(![]() -C2H5)=0.12mol/L,c(
-C2H5)=0.12mol/L,c(![]() -CH=CH2)=0.08mol/L,c(H2)=0.08mol/L,
-CH=CH2)=0.08mol/L,c(H2)=0.08mol/L,
k=![]() =0.053molL-1,故答案为:0.14;0.053molL-1;
=0.053molL-1,故答案为:0.14;0.053molL-1;
(2)由化学方程式可知,增大压强,平衡向逆反应方向移动,则体系总压强一定时,水蒸气的分压越大,平衡体系的分压越小,平衡向气体体积增大的方向移动,所以转化率增大,故答案为:越大;体系总压强一定时,水蒸气的分压越大,平衡体系的分压越小,平衡向气体体积增大的方向移动;
(3)酸性氢氧燃料电池中,正极上氧气得电子发生还原反应,反应的电极方程式为O2+4H++4e-=2H2O,故答案为:O2+4H++4e-=2H2O;
(4)在相同条件下,若最初向该容器中充入![]() -CH=CH2(g)和H2(g),假设在40min时达到上述同样的平衡状态,平衡时,c(
-CH=CH2(g)和H2(g),假设在40min时达到上述同样的平衡状态,平衡时,c(![]() -C2H5)=0.12mol/L,c(
-C2H5)=0.12mol/L,c(![]() -CH=CH2)=0.08mol/L,c(H2)=0.08mol/L,起点(0,0.20)、终点在(40,0.08);苯乙烷曲线变化趋势在增大,弓向浓度轴,且起点(0,0)、终点(40,0.12),则图像为
-CH=CH2)=0.08mol/L,c(H2)=0.08mol/L,起点(0,0.20)、终点在(40,0.08);苯乙烷曲线变化趋势在增大,弓向浓度轴,且起点(0,0)、终点(40,0.12),则图像为 ,故答案为:
,故答案为: 。
。