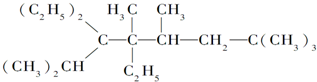
题目内容
用价层电子对互斥理论(VSEPR)判断下列分子或离子的空间构型
①H2S: ,②ClO4-: .
①H2S:
考点:判断简单分子或离子的构型
专题:化学键与晶体结构
分析:根据价层电子对互斥理论确定其空间构型,价层电子对个数=σ键个数+孤电子对个数,据此分析解答.
解答:
解:①H2S分子中价层电子对个数=σ键个数+孤电子对个数=2+2=4,而中心原子外围只有两个原子所以含有2个孤电子对,即H2S为V型结构,故答案为:V型;
②ClO4-离子中价层电子对个数=σ键个数+孤电子对个数=4+0=4,中心原子外围有四个原子所以不含有孤电子对,即ClO4-为正四面体结构,故答案为:正四面体.
②ClO4-离子中价层电子对个数=σ键个数+孤电子对个数=4+0=4,中心原子外围有四个原子所以不含有孤电子对,即ClO4-为正四面体结构,故答案为:正四面体.
点评:本题考查了粒子空间构型的判断,根据价层电子对互斥理论来分析解答即可,注意孤电子对个数的计算方法,为易错点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
元素周期表中相邻的3种元素X、Y、Z,它们的核电荷数之和为35,这3种元素可能是( )
| A、P、Si、C |
| B、F、Cl、Ne |
| C、Si、S、P |
| D、Ne、O、F |
人类最早大量使用的金属是( )
| A、金 | B、银 | C、铜 | D、铁 |
某无色溶液中只可能溶有NH4+、K+、Al3+、Mg2+、HCO3-、Cl-、I-、MnO4-、SO42-等离子中的几种离子.为分析其组成,现进行如下实验:
①取10mL该溶液于试管中滴加足量的Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀甲.
②取上述反应后的滤液,加入AgNO3溶液未见沉淀产生.
③另取10mL该溶液于试管中,滴加NaOH溶液产生白色沉淀乙,当加入NaOH的物质的量为0.03mol时,沉淀的量达到最大;继续滴加NaOH溶液并加热,开始产生气体丙,收集气体丙,换算成标况下为0.224L(假设丙全部逸出),最后沉淀完全溶解.
则下列说法正确的是( )
①取10mL该溶液于试管中滴加足量的Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀甲.
②取上述反应后的滤液,加入AgNO3溶液未见沉淀产生.
③另取10mL该溶液于试管中,滴加NaOH溶液产生白色沉淀乙,当加入NaOH的物质的量为0.03mol时,沉淀的量达到最大;继续滴加NaOH溶液并加热,开始产生气体丙,收集气体丙,换算成标况下为0.224L(假设丙全部逸出),最后沉淀完全溶解.
则下列说法正确的是( )
| A、仅由实验①可推出肯定含有SO42-,不含Cl- |
| B、该无色溶液肯定含有NH4+、K+、Al3+、SO42- |
| C、该无色溶液肯定不含K+、Mg2+、HCO3-、Cl-、MnO4-、I- |
| D、不能确定该无色溶液是否含有K+ |
绿原酸的结构简式如图,下列有关绿原酸的说法不正确的是( )
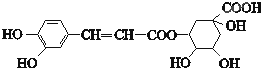
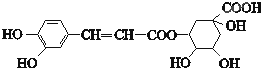
| A、分子式为C16H18O9 |
| B、0.1mol绿原酸最多与0.8mol NaOH反应 |
| C、能发生取代反应和消去反应 |
| D、能与Na2CO3反应 |
下列变化中,属于物理变化的是( )
A、 火箭发射 |
B、 煤的燃烧 |
C、 风力发电 |
D、 酸雨侵蚀 |
下列用来表示物质变化的化学用语中,正确的是( )
| A、明矾水解的离子方程式:Al3++3H2O?Al(OH)3↓+3H+ | ||||
| B、电镀时,要在铁上镀银,则正极为银,电极反应式为:Ag++e-═Ag | ||||
C、以石墨作电极电解氯化镁溶液:2Cl-+2H2O
| ||||
D、表示氢气燃烧热的化学方程式:H2(g)+
|
 碳酸镁晶须是一种新型的吸波隐形材料中的增强材料.已知某碳酸镁晶须样品的组成为MgCO3?nH2O (n为1~5的正整数),通过对其进行热重分析得到如图所示的热重曲线,试根据曲线计算n=
碳酸镁晶须是一种新型的吸波隐形材料中的增强材料.已知某碳酸镁晶须样品的组成为MgCO3?nH2O (n为1~5的正整数),通过对其进行热重分析得到如图所示的热重曲线,试根据曲线计算n=