题目内容
现有一包含有杂质(杂质不能与酸反应)的氢氧化钠固体,为测定其纯度,取m g固体溶于水,配成100mL溶液,进行如下实验:
a.取25.0mL所配溶液于锥形瓶中,并滴加2~3滴酚酞试液
b.用c mol?L-1标准盐酸润洗滴定管2~3次
c.把盛有标准盐酸的滴定管固定好,调节滴定管的尖嘴使之充满溶液
d.取标准盐酸并注入滴定管中至“0”刻度以上2~3mL处
e.调节液面到“0”或“0”刻度以下,记下读数
f.把锥形瓶放在滴定管的下方,用标准盐酸滴定至终点并记下滴定管的计数
请回答下列问题
(1)在滴定过程中,目光应注视
(2)正确的是操作顺序是:b→d→
(3)若滴定前后两次读数分别为a和b,则实验所配得NaOH溶液的物质的量浓度为
mol/L
mol/L,NaOH的纯度为
%
%.
(4)若读取读数a时仰视,读取读数b时俯视,则所测氢氧化钠的纯度
a.取25.0mL所配溶液于锥形瓶中,并滴加2~3滴酚酞试液
b.用c mol?L-1标准盐酸润洗滴定管2~3次
c.把盛有标准盐酸的滴定管固定好,调节滴定管的尖嘴使之充满溶液
d.取标准盐酸并注入滴定管中至“0”刻度以上2~3mL处
e.调节液面到“0”或“0”刻度以下,记下读数
f.把锥形瓶放在滴定管的下方,用标准盐酸滴定至终点并记下滴定管的计数
请回答下列问题
(1)在滴定过程中,目光应注视
锥形瓶内溶液的颜色变化
锥形瓶内溶液的颜色变化
,判断滴定终点的标准是锥形瓶中的溶液颜色由红色变为无色,且半分钟不褪色
锥形瓶中的溶液颜色由红色变为无色,且半分钟不褪色
.(2)正确的是操作顺序是:b→d→
c→e→a
c→e→a
→f.(填字母)(3)若滴定前后两次读数分别为a和b,则实验所配得NaOH溶液的物质的量浓度为
| c(b-a) |
| 25 |
| c(b-a) |
| 25 |
| 16c(b-a) |
| m |
| 16c(b-a) |
| m |
(4)若读取读数a时仰视,读取读数b时俯视,则所测氢氧化钠的纯度
偏小
偏小
(填“偏大”、“偏小”或“不变”)分析:(1)眼睛观察锥形瓶中溶液颜色变化;根据滴定中滴定终点的正确错误完成;
(2)根据正确的滴定操作进行排序;
(3)根据消耗标准液盐酸的体积及浓度计算出氢氧化钠的浓度和纯度.
(4)开始仰视读数,导致读数偏大;后来俯视读数,导致读数偏小,最终消耗的标准液体积偏小.
(2)根据正确的滴定操作进行排序;
(3)根据消耗标准液盐酸的体积及浓度计算出氢氧化钠的浓度和纯度.
(4)开始仰视读数,导致读数偏大;后来俯视读数,导致读数偏小,最终消耗的标准液体积偏小.
解答:解:(1)在滴定过程中,目光应注视锥形瓶内溶液的颜色变化;当锥形瓶中的溶液颜色由红色变为无色,且半分钟不褪色,即为滴定终点,
故答案为:锥形瓶内溶液的颜色变化;锥形瓶中的溶液颜色由红色变为无色,且半分钟不褪色;
(2)按照润洗酸式滴定管、量取标准液、固定酸式滴定管、调整液面0刻度以下、用锥形瓶取待测液的顺序,即bdceaf顺序,
故答案为c→e→a;
(3)消耗的标准液的体积为:(b-a)mL,物质的量为c×(b-a)×10-3mol,氢氧化钠的浓度为:
=
mol/L,
配成的100mL溶液中氢氧化钠的物质的量为:
mol/L×0.1L,氢氧化钠的纯度为:
×100%=
%,
故答案为:
mol/L;
%;
(4)由于读取读数a时仰视,导致读数偏大;读取读数b时俯视,导致读数偏小,滴定消耗的标准液体积(b-a)偏小,氢氧化钠的物质的量偏低,纯度偏小,
故答案为:偏小.
故答案为:锥形瓶内溶液的颜色变化;锥形瓶中的溶液颜色由红色变为无色,且半分钟不褪色;
(2)按照润洗酸式滴定管、量取标准液、固定酸式滴定管、调整液面0刻度以下、用锥形瓶取待测液的顺序,即bdceaf顺序,
故答案为c→e→a;
(3)消耗的标准液的体积为:(b-a)mL,物质的量为c×(b-a)×10-3mol,氢氧化钠的浓度为:
| c×(b-a)×10-3mol |
| 0.025L |
| c(b-a) |
| 25 |
配成的100mL溶液中氢氧化钠的物质的量为:
| c(b-a) |
| 25 |
| ||
| m |
| 16c(b-a) |
| m |
故答案为:
| c(b-a) |
| 25 |
| 16c(b-a) |
| m |
(4)由于读取读数a时仰视,导致读数偏大;读取读数b时俯视,导致读数偏小,滴定消耗的标准液体积(b-a)偏小,氢氧化钠的物质的量偏低,纯度偏小,
故答案为:偏小.
点评:本题考查了酸碱中和滴定,涉及了溶液的配制、滴定操作顺序、误差分析等知识,本题难度中等.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
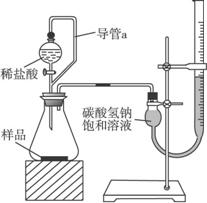
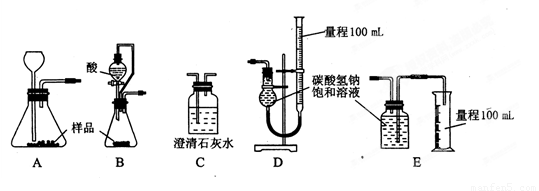
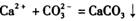 的反应设计了如下方案:称取样品→配成溶液→加入足量浓CaCl2溶液→充分反应后过滤→洗涤→干燥→称量→计算纯度。
的反应设计了如下方案:称取样品→配成溶液→加入足量浓CaCl2溶液→充分反应后过滤→洗涤→干燥→称量→计算纯度。
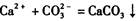 的反应设计了如下方案:称取样品→配成溶液→加入足量浓CaCl2溶液→充分反应后过滤→洗涤→干燥→称量→计算纯度。
的反应设计了如下方案:称取样品→配成溶液→加入足量浓CaCl2溶液→充分反应后过滤→洗涤→干燥→称量→计算纯度。