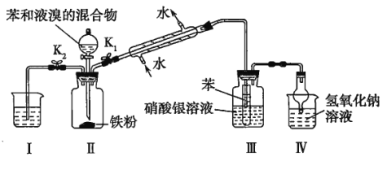
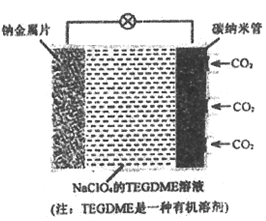
题目内容
【题目】为了减轻大气污染,可在汽车尾气排放处加装“催化净化器”装置。
(1)通过“催化净化器”的CO、NO在催化剂和高温作用下可发生可逆反应,转化为参与大气循环的无毒混合气体,写出该反应的化学方程式:__。
(2)在一定温度下,向1L密闭恒容容器中充入1molNO、2molCO,发生上述反应,10s时反应达到平衡,此时CO的物质的量为1.2mol。请回答下列问题:
①前10s内平均反应速率v(CO)=___。
②在该温度下反应的平衡常数K=___。
③关于上述反应,下列叙述正确的是___(填字母)。
A.达到平衡时,移走部分CO2,平衡将向右移动,正反应速率加快
B.扩大容器的体积,平衡将向右移动
C.在相同的条件下,若使用甲催化剂能使正反应速率加快105倍,使用乙催化剂能使逆反应速率加快108倍,则应该选用乙催化剂
D.若保持平衡时的温度不变,再向容器中充入0.8molCO和0.4molN2,则此时v正>v逆
④已知上述实验中,c(CO)与反应时间t变化曲线Ⅰ如图:

若其他条件不变,将1molNO、2molCO投入2L容器进行反应,请在图中绘出c(CO)与反应时间t1变化曲线Ⅱ___(不要求标出CO的终点坐标)。
(3)测试某汽车冷启动时的尾气催化处理,CO、NO百分含量随时间变化曲线如图:

请回答:
前0~10s阶段,CO、NO百分含量没明显变化的原因是___。
【答案】2NO+2CO![]() N2+2CO2 0.08mol·L-1·s-1
N2+2CO2 0.08mol·L-1·s-1 ![]() (或4.44) CD
(或4.44) CD 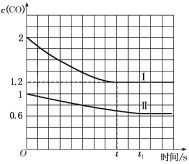 尚未达到催化剂工作温度(或尚未达到反应的温度)
尚未达到催化剂工作温度(或尚未达到反应的温度)
【解析】
(1)CO、NO在催化剂和高温作用下发生可逆反应,转化为参与大气循环的无毒混合气体,结合原子守恒推知,无毒混合气体为CO2和N2,结合原子守恒和得失电子守恒写出化学方程式。
(2)①反应速率=![]() ;
;
②结合平衡三段式列式计算平衡浓度,平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积得到;
③依据化学平衡移动原理分析选项,改变条件,平衡向减弱这种改变的方向进行;
④反应前后气体体积减小,若其它条件不变,将1molNO、2molCO投入2L容器进行反应,相当于原来的平衡状态减小压强,平衡浓度减小,反应速率减小,平衡向气体体积增大的分析进行;
(3)汽车冷启动时的尾气催化处理CO、NO百分含量随时间变化曲线变化分析,开始的气体含量变化不大,说明温度低,催化剂的作用未起作用。
(1)由NO、CO相互反应转换成无毒的气体,即生成氮气和二氧化碳,该反应的化学反应方程式为2NO+2CO![]() N2+2CO2;
N2+2CO2;
(2)在一定温度下,向1L密闭容器中充入1molNO、2molCO,发生上述反应②,10S反应达平衡,此时CO的物质的量为1.2mol,依据化学平衡三段式列式计算:
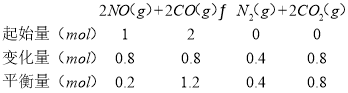
①前10s内平均反应速率v(CO)=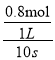 =0.08molL-1S-1;
=0.08molL-1S-1;
②体积为1L,该温度下平衡常数K=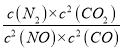 =
=![]() =
=![]() ;
;
③A.达到平衡时,移走部分CO2,平衡将向右移动,正反应速率减小,故A错误;
B.反应是气体体积减小的反应,缩小容器的体积,压强增大,平衡将向右移动,故B正确;
C.催化剂对正逆反应速率影响程度相同,在相同的条件下,若使用甲催化剂能使正反应速率加快105倍,使用乙催化剂能使逆反应速率加快108倍,则应该选用乙催化剂,故C正确;
D.若保持平衡时的温度不变,再向容器中充入0.8molCO和0.4molN2,浓度商Qc=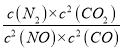 =
=![]() =3.2<K=
=3.2<K=![]() ,平衡正向进行,则此时v正>v逆 ,故D正确;
,平衡正向进行,则此时v正>v逆 ,故D正确;
故答案为CD;
④其他条件不变,将1 mol NO和2 mol CO投入2 L容器中进行反应,可分两步先将1 mol NO和2 mol CO投入1 L容器中进行反应,再将容器的容积由1 L变为2 L,第一步与原平衡状态相同,第二步平衡向左移动,达平衡时c(CO)稍大于0.6 mol·L-1;由于各气体的浓度减小,反应速率减慢,达到平衡所用时间比原来增长,画出的图象为: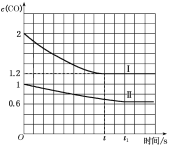 ;
;
(3)汽车冷启动时的尾气催化处理CO、NO百分含量随时间变化曲线变化分析,开始的气体含量变化不大,说明温度低,催化剂的作用未起作用;证明反应未达到催化剂工作温度(或尚未达到反应的温度)。

【题目】以赤铁矿(主要成分为60.0%Fe2O3,杂质为3.6%FeO,Al2O3,MnO2,CuO等)为原料制备高活性铁单质的主要生产流程如图所示:

已知部分阳离子以氢氧化物形式完全沉淀时溶液的pH如表所示:
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Cu(OH)2 |
pH | 3.4 | 5.2 | 9.7 | 6.7 |
请回答下列问题:
(1)含杂质的赤铁矿使用前要将其粉碎,目的是___。操作Ⅰ的名称是___。
(2)将操作Ⅰ后所得的MnO2与KClO3、KOH溶液混合共热,可得到K2MnO4,此反应的化学方程式是____。
(3)将pH控制在3.6的目的是___。已知25℃时,Ksp[Cu(OH)2]=2×10-20,该温度下反应Cu2++2H2O![]() Cu(OH)2+2H+的平衡常数K=___。
Cu(OH)2+2H+的平衡常数K=___。
(4)加入双氧水时反应的离子方程式为___。
(5)利用氨气在500℃以上分解得到的氮原子渗透到铁粉中可制备氮化铁(FexNy),若消耗氨气17.0g,消耗赤铁矿石1kg,写出该反应完整的化学方程式:___。
【题目】甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素。
(1)该反应的离子方程式为__________________________。
设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
(2)甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小。实验装置如图,实验时分液漏斗中A溶液一次性放下,A、B的成分见下表:

序号 | A溶液 | B溶液 |
① | 2 mL 0.1 mol/L H2C2O4溶液 | 4 mL 0.01 mol/L KMnO4溶液 |
② | 2 mL 0.2 mol/L H2C2O4溶液 | 4 mL 0.01 mol/L KMnO4溶液 |
③ | 2 mL 0.2 mol/L H2C2O4溶液 | 4 mL 0.01 mol/L KMnO4溶液和少量MnSO4 |
该实验探究的是______对化学反应速率的影响。在反应停止之前,相同时间内针管中所得CO2的体积由大到小的顺序是____________(用实验序号填空)。
(3)乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率的大小。取两支试管各加入2 mL 0.1 mol/L H2C2O4溶液,另取两支试管各加入4 mL 0.1 mol/L KMnO4溶液。将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合并振荡,记录溶液褪色所需时间。该实验目的是研究_________对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是____________。