题目内容
【题目】许多国家十分重视海水资源的综合利用。不需要化学变化就能从海水中获得的物质是( )
A.溴单质、碘单质B.钠 、镁C.氧气 、氢气D.食盐 、淡水
【答案】D
【解析】
A.溴离子和碘离子被氧化为溴单质和碘单质的过程都是化学变化,故A错误;
B. 电解熔融氯化钠制得钠和电解熔融氯化镁制得镁的过程都是化学变化,故B错误;
C.电解水制得氧气和氢气的过程是化学变化,故C错误;
D.海水晒盐和海水蒸馏得到淡水的过程,都没有新物质生成,是物理变化,故D正确;
故选D。

 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案【题目】今有A、B两种原子,已知A原子的核外电子总数是B原子核外电子总数的1/2倍,B原子的L层电子数为A原子L层电子数的2倍,A和B分别是( )
A. 硼和氦 B. 碳和镁 C. 氯和碳 D. 铍和氧
【题目】工业以软锰矿(主要成分是 MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:
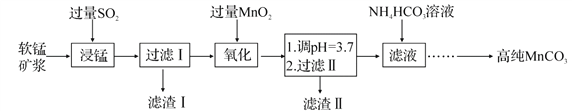
已知:25℃时,部分金属阳离子以氢氧化物形式沉淀时溶液的pH 如下表所示。
金属阳离子 | Fe3+ | Fe2+ | Mn2+ |
开始沉淀的pH | 2.7 | 7.6 | 8.3 |
完全沉淀的pH | 3.7 | 9.7 | 9.8 |
(1)“浸锰”过程中 Fe2O3与SO2反应的离子方程式为 Fe2O3+SO2+2H+ =2Fe2++SO42-+H2O,该反应是经历以下两步反应实现的。
写出ⅱ的离子方程式:_______________________。
ⅰ:Fe2O3+6H+ =2Fe3++3H2O ⅱ:……
(2)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为_________ (填离子符号)。
(3)写出“氧化”过程中MnO2 与Fe 2+反应的离子方程式:___________。
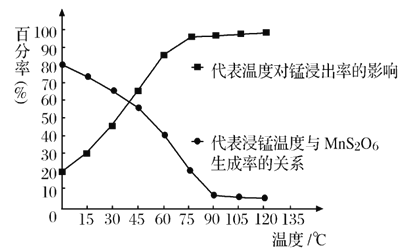
(4)“浸锰”反应中往往有副产物 MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是;_____滤渣Ⅱ的成分是______ (写化学式);向过滤Ⅱ所得的滤液中加入NH4HCO3 溶液时温度不宜太高的原因是______________。
(5)加入NH4HCO3溶液后,生成 MnCO3沉淀,同时还有气体生成,写出反应的离子方程式:__________________ 。
(6)生成的 MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是_______________。