题目内容
将20.00g NaCl和NaBr的混合物溶于适量水中,通入足量氯气,充分反应后,将溶液蒸干、冷却、称量,得到固体15.55g.则原混合物中溴元素的质量分数为
[ ]
A.51.5%
B.48.5%
C.40%
D.60%
答案:C
解析:
解析:
|
设原混合物中所含溴的质量为x,根据反应:2NaBr+
原混合物中溴元素的质量分数为:
|

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
(1)900 K时,用足量的H2与钠钾合金10.10 g充分反应,得到10.40g白色的氢化物混合物,则该钠钾合金的化学式为____________。
(2)将l.56 g Na2O2加入20.00g水中,充分反应后,所得溶液的质量分数为________(保留3位小数,用百分数表示保留l位小数);25℃时NaOH的溶解度为53.00 g/100g水,则将该溶液蒸发_______g水后恢复至25℃可得饱和溶液(保留2位小数)。
(3)取10.00 gNaNO3加热,得到的固体中Na的质量分数为31.51%,则氧的质量分数为_________(保留2位小数)。
(4)某碱金属R与汞的合金2.4g加入足量水中,充分反应后,收集到气体l.12 L(标准状况),则可推导出R元素是________(写元素符号)。
(5)在l.12 L密闭容器中,将KOH与O3在一定条件下反应,得到气体(只含一种元素)、固体物质A和KOH·H2O。有关实验数据如下:
|
KOH |
O3 |
A |
KOH·H2O |
气体密度 |
|
16.8 g |
0.3 mol |
a g |
b g |
>1.429 g/L |
|
16.8 g |
0.2 mol |
a g |
b g |
1.429 g/L |
A会缓慢分解产生一种钾的氧化物和O2。试确定A的化学式: 。

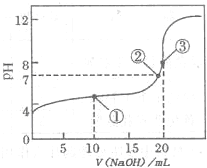 (2011?巢湖二模)滴定法是化学定量分析的一种重要而普遍的方法.
(2011?巢湖二模)滴定法是化学定量分析的一种重要而普遍的方法.