题目内容
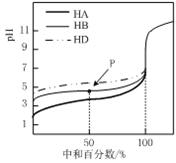
【题目】室温下向![]() 溶液中逐滴加入
溶液中逐滴加入![]() 的一元酸HA,溶液的pH的变化曲线如图所示, 不正确的是
的一元酸HA,溶液的pH的变化曲线如图所示, 不正确的是
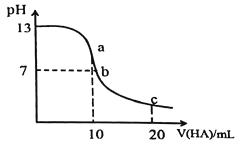
A.a点时,溶液中存在![]()
B.b点时,![]()
C.c点时,溶液中存在![]()
D.水的电离程度:![]()
【答案】B
【解析】
A.a点时酸碱恰好中和,溶质为NaA,NaA水解呈碱性,A![]() 水解,溶液中
水解,溶液中![]() A
A![]() ,故A正确;
,故A正确;
B.b点所示溶液呈中性,则![]() ,由电荷守恒得:
,由电荷守恒得:![]() ,所以
,所以![]() ,但由图像分析
,但由图像分析![]() ,故B错误;
,故B错误;
C.c点溶质为等浓度的NaA和HA,由电荷守恒得:![]() ,再由物料守恒得:
,再由物料守恒得:![]() ,两守恒式子消掉
,两守恒式子消掉![]() 后溶液中存在
后溶液中存在![]() ,故 C正确;
,故 C正确;
D.根据图象知,该酸是弱酸,a、b点的溶质分别是盐、盐和酸,a点盐类水解促进水电离,b溶液呈中性,水的电离程度不受影响,所以a、b两点溶液中水的电离程度:![]() ,故D正确。
,故D正确。
故选B。

 智慧小复习系列答案
智慧小复习系列答案【题目】辉铜矿主要成分为Cu2S,软锰矿主要成分为MnO2,它们都含有少量SiO2、Fe2O3等杂质。工业上综合利用这两种矿物制备硫酸锰和碱式碳酸铜的主要工艺流程如下:
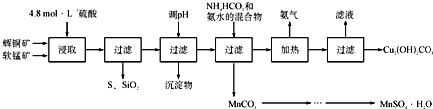
已知:①MnO2能将金属硫化物中的硫氧化为单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水中会分解生成NH3;
③部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0molL-1计算):
开始沉淀的pH | 沉淀完全的pH | |
Fe 3+ | 1.1 | 3.2 |
Mn2+ | 8.3 | 9.8 |
Cu2+ | 4.4 | 6.4 |
(1)酸浸时,为了提高浸取率可采取的措施有____________________(任写一点);
(2)调节浸出液pH的范围为____________,其目的是_______________________;
(3)本工艺中可循环使用的物质是____________________(写化学式).
(4)在该工艺的“加热驱氨”环节,若加热的温度较低或过高,都将造成_________________的结果;
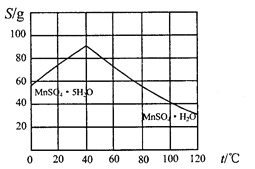
(5)碳酸锰在一定条件下可得硫酸锰溶液,试根据如下曲线图示,现由硫酸锰溶液制备MnSO4·H2O的实验方案为____________________。
(6)用标准BaCl2溶液测定样品中MnSO4H2O质量分数时,发现样品纯度大于100%(测定过程中产生的误差可忽略),其可能原因有_________________(任写一种)。