题目内容
现有等体积混合而成的四组气体:①NO2+NO;②NO2+O2;③HCl+N2;④NO+N2,将其分别通入体积相同的试管,并立即倒立于水槽中,试管内水面上升的高度分别为H1,H2,H3,H4,其中高度关系是
| A.H2>H3>H1>H4 | B.H3>H2>H1>H4 |
| C.H1=H2=H3=H4 | D.H1>H2>H3>H4 |
A
试题分析:设试管体积为1,①NO2+NO与水反应后的产物为NO,其体积为2/3,②NO2+O2与水反应二氧化氮不足,与氧气,其体积为3/8,③HCl+N2,氯化氢易溶于水,最后余氮气,体积为1/2,④NO+N2都不溶于水,体积仍为1,所以水面上升的体积分别是1/3、5/8、1/2、0,5/8>1/2>1/3>0,即 H2>H3>H1>H4,答案选A。

练习册系列答案
相关题目
 6CaO(s)+P4(s)+10CO(g)ΔH1="+3" 359.26 kJ·mol-1
6CaO(s)+P4(s)+10CO(g)ΔH1="+3" 359.26 kJ·mol-1 20Cu3P +24H3PO4+60H2SO4 6 mol CuSO4能氧化白磷的物质的量是 。
20Cu3P +24H3PO4+60H2SO4 6 mol CuSO4能氧化白磷的物质的量是 。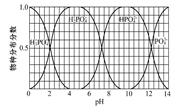
 )与季戊四醇(
)与季戊四醇(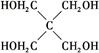 )以物质的量之比2∶1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X的核磁共振氢谱如下图所示。
)以物质的量之比2∶1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X的核磁共振氢谱如下图所示。


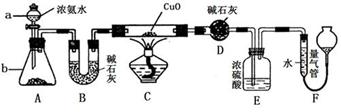
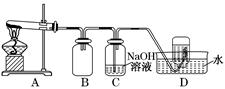
 2KNO2↑+O2↑
2KNO2↑+O2↑