��Ŀ����
�о���Ԫ�ؼ��仯��������ʾ�����Ҫ���塣
I.������ͼװ��ģ�ҵ������SO2�������ķ�Ӧ���о�SO2�����ʣ�
���۵㣺SO2 ��76.1�棬SO3 16.8�棻�е㣺SO2 ��10�棬SO3 45�棩
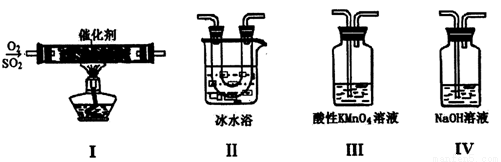
��1����ͬѧ��I��II��III��IV��˳������װ�ã�װ��II��������_________��װ��III����Һ����ɫ��֤�������������___________�ԡ�
��2����ͬѧ������˳������װ��(װ�â��г����ȴ)����װ�â�����40 mL 3.0mol/L NaOH��Һ����Ӧ������5.12 g����װ�â��з�����Ӧ�Ļ�ѧ����ʽ��_______________��
��3��ijͬѧ��������SO2ͨ��һ֧װ���Ȼ�����Һ���Թ��У�δ���������ɡ�����Թ��м�������________������ĸ�������ܲ���������
A��������Һ B����ˮ C������ D���������Һ
��Ϊ�о����ʲ�������Ũ����ķ�Ӧ��ijѧϰС�����������̽�����
��ȡ����(̼�ظ�)6g����15mLŨ�����У����ȣ���ַ�Ӧ��õ���ҺX���ռ�������Y��
��4����ͬѧ��ΪX�г�Fe3������ܺ���Fe2������Ҫȷ�����е�Fe2��Ӧѡ��________������ţ���
a��KSCN��Һ����ˮ b������������Һ
c������KMnO4��Һ d�����ۺ�KSCN��Һ
��5����ͬѧȡ784mL(��״��)����Yͨ������H2O2ˮ��Һ�У�Ȼ���������BaCl2��Һ�����ʵ�������ø������4.66g���ɴ���֪����Y��SO2������ٷ���Ϊ____________��������С�����һλ��
��6����������ʵ����SO2��������Ľ������ͬѧ��Ϊ����Y�л����ܺ���H2��CO2����,����CO2��������_______________(�û�ѧ����ʽ��ʾ)
 ���ĺ����Ͼ�������ϵ�д�
���ĺ����Ͼ�������ϵ�д�

 ����
���� I2(g) + H2(g)��ƽ�������˵���϶���ȷ���ǣ���
I2(g) + H2(g)��ƽ�������˵���϶���ȷ���ǣ���
 ��CO
��CO

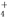 ��SO
��SO
 A��OH��
A��OH��