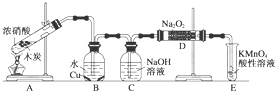
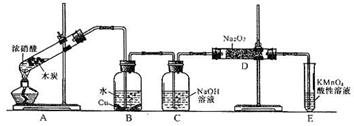
题目内容
已知,室温下存在反应3HNO2===HNO3+2NO↑+H2O;在酸性溶液中,NO![]() 可将 MnO
可将 MnO![]() 还原为Mn2+且无气体生成;酸性KMnO4溶液可吸收氮的氧化物。某化学兴趣小组设计了如下探究实验(实验前先排尽装置中的空气):
还原为Mn2+且无气体生成;酸性KMnO4溶液可吸收氮的氧化物。某化学兴趣小组设计了如下探究实验(实验前先排尽装置中的空气):

请回答下列问题:
(1)装置A的试管中发生反应的化学方程式是 。
(2)B瓶中可以观察到的现象是 ,C瓶出来的气体是 。
(3)实验时观察到D 管内固体颜色逐渐变为白色。据此甲同学认为D管中生成物是NaNO3,而乙同学则认为D管中生成的是NaNO2,如何证明乙同学的观点正确?
| 实验操作 | 实验现象 | 实验结论 |
| D管生成的是NaNO2 |
(4)E装置的作用是 。
(5)同学们经讨论认为上述装置仍有缺陷,为了避免D管中生成NaOH,你认为应该进行的改进是 。
(1)C+4HNO3(浓)CO2↑+4NO2↑+2H2O (2分)
(2)产生无色气体,溶液逐渐变蓝 (2分) NO (1分)
(3)(2分)
| 实验操作 | 实验现象 | 实验结论 |
| 方案Ⅰ:将生成物置于试管中,加入稀硫酸 | 产生无色气体并在液面上方变为红棕色 | D管生成的是NaNO2 |
| 实验操作 | 实验现象 | 实验结论 |
| 方案Ⅱ:将生成物置于试管中,加入酸性KMnO4溶液 | ,溶液紫色褪去 | D管生成的是NaNO2 |
(4)吸收D中未反应完的NO,以免污染空气(2分)
(5)在C、D之间增加一个盛浓硫酸的洗气瓶(或装无水CaCl2的干燥管)(2分)

 计算高手系列答案
计算高手系列答案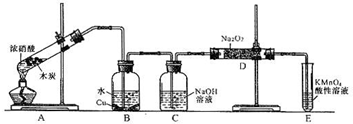

 可将MnO
可将MnO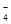 还原为Mn2+且无气体生成。写出检验D中产物是亚硝酸钠的方法:
还原为Mn2+且无气体生成。写出检验D中产物是亚硝酸钠的方法: