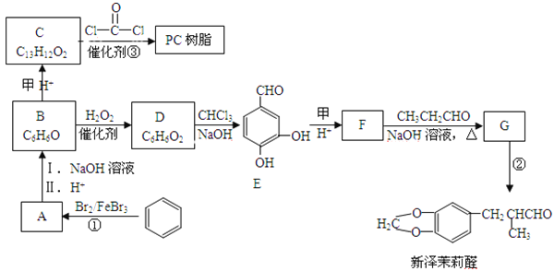
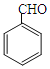
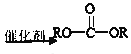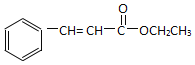题目内容
【题目】已知反应 A+B===C+D 的能量变化如图所示,下列叙述正确的是( )

A.A 的能量一定低于 C 的能量,B 的能量一定低于 D 的能量
B.因为该反应为吸热反应,故一定要加热,反应才能进行
C.破坏反应物中的化学键所吸收的能量一定小于形成生成物中化学键所放出的能量
D.A 和 B 的总能量一定低于 C 和 D 的总能量
【答案】D
【解析】
A.由图可知该反应为吸热反应,则A与B的总能量小于C与D的总能量,但无法确定A与C、B与D的能量高低,故A错误;
B.由图可知该反应为吸热反应,与反应条件无关,该反应可能需要加热,也可能不需要加热,如氢氧化钡晶体和氯化铵反应瞬间完成,是吸热反应,不需加热,故B错误;
C.由图可知该反应为吸热反应,则断裂化学键吸收的热量大于生成化学键释放的能量,故C错误;
D.反应A+B=C+D为吸热反应,则A和B的总能量一定低于C和D的总能量,故D正确;
故答案:D。

 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案【题目】下表是在相同温度下三种酸的一些数据,下列判断正确的是
酸 | HX | HY | HZ | ||
浓度(mol/L) | 0.12 | 0.2 | 0.9 | 1 | 1 |
电离度 | 0.25 | 0.2 | 0.1 | 0.3 | 0.5 |
电离常数 | K1 | K2 | K3 | K4 | K5 |
A.在相同温度,从HX的数据可以说明:弱电解质溶液,浓度越低,电离度越大,且K1>K2>K3=0.01
B.室温时,若在NaZ溶液中加水,则c(Z-)/ [c(HZ) c(OH-)]的比值变小,若加少量盐酸,则比值变大
C.等物质的量的NaX、NaY和NaZ的混合,c(X-)+c(Y-)-2c(Z-)=2c(HZ)-c(HX)-c(HY),且c(Z-)<c(Y-)<c(X-)
D.在相同温度下,K5>K4>K3
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题。
| IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)元素②的原子结构示意图为_____。
(2)元素③、④、⑤、⑥原子半径由大到小为_____。
(3)上述 8 种元素中,非金属性最强的是_____。
(4)元素②、③形成的气态氢化物稳定性:_____>_____;元素①、③、⑤可形成既含离子键又含极性共价键的化合物,写出其电子式:_____。
(5)元素⑦的最高价氧化物对应的水化物与元素⑤最高价氧化物对应的水化物溶液反应的离子方程式为_____。
(6)写出金属铜与②最高价氧化物对应的水化物稀溶液反应的离子方程式_____。
(7)从原子结构的角度解释元素③和⑦的非金属性强弱:_____