题目内容
【题目】下列说法正确的是
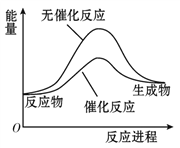
A. 如图可表示水分解过程中的能量变化
B. 相同条件下,如果1 mol氢原子所具有的能量为E1,1 mol氢分子所具有的能量为E2,则2E1<E2
C. 需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应
D. 已知:①H2(g)+Cl2(g) ![]() 2HCl(g) ΔH=-a kJ/mol,
2HCl(g) ΔH=-a kJ/mol,
②![]() 。
。
且a、b、c均大于零,则断开1 mol H—Cl键所需的能量为(-a-b-c)kJ
【答案】A
【解析】A、水的分解反应属于吸热反应,反应物能量低于生成物能量,催化剂降低反应的活化能,加快反应速率,但不改变反应热;图象符合要求,故A正确;B、形成化学键要放出热量,如果1 mol氢原子所具有的能量为E1,1 mol氢分子所具有的能量为E2,则2E1>E2,故B错误;C、某些放热反应需要加热才能反应,常温发生的反应不一定是放热反应,如Ba(OH)28H2O和NH4Cl反应是吸热反应,常温下进行,故C错误;D、△H=bkJ/mol+ckJ/mol-2H-Cl键能=-akJ/mol;所以H-Cl键能=![]() kJ/mol;断开1 mol H-Cl键所需吸收的能量为
kJ/mol;断开1 mol H-Cl键所需吸收的能量为![]() kJ,故D错误;故选A。
kJ,故D错误;故选A。

练习册系列答案
相关题目