题目内容
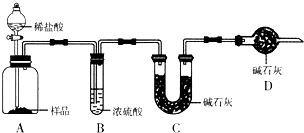 现有甲、乙、丙三个学生,欲测定某工业纯碱样品中Na2CO3的质量分数(纯碱样品中Na2CO3的质量分数为92%~96%),分别设计如下实验方案,请你帮助他们完成实验.
现有甲、乙、丙三个学生,欲测定某工业纯碱样品中Na2CO3的质量分数(纯碱样品中Na2CO3的质量分数为92%~96%),分别设计如下实验方案,请你帮助他们完成实验.甲:用
乙:准确称取10.00g样品后,用
|
丙:准确称取10.00g样品后,向其中加入过量的盐酸,充分反应直至样品中无气泡冒出,蒸干混合溶液将所得的固体物质置于干燥器中,冷却至室温后称量.反复加热、冷却、称量,直至所称量的固体的质量几乎不变为止,此时所得固体的质量为10.99g.请分析、计算后填表:
| 分析与计算 分组 |
计算样品中碳酸钠的质量分数 | 实验结果的评价 | 实验失败的主要原因及对结果的影响 |
| 甲 | ① |
失败 | ② |
| 乙 | ③ |
成功 | ----- |
| 丙 | ④ |
成功 | ---- |
乙:配制溶液的仪器是1000ml容量瓶,溶解物质的烧杯和玻璃棒,定容时用到的胶头滴管;碳酸钠溶液水解呈碱性,应选择碱式滴定管;
丙:准确称取10.00g样品后,向其中加入过量的盐酸,充分反应直至样品中无气泡冒出,蒸干混合溶液将所得的固体物质置于干燥器中,冷却至室温后称量.反复加热、冷却、称量,直至所称量的固体的质量几乎不变为止,此时所得固体的质量为10.99g;
依据题干条件分别计算甲、乙、丙中碳酸钠的含量分析判断;
故答案为:托盘天平、药匙、滤纸;防止空气中的水蒸气和二氧化碳进入装置C,减少误差;
乙:配制溶液的仪器是1000ml容量瓶,溶解物质的烧杯和玻璃棒,定容时用到的胶头滴管;碳酸钠溶液水解呈碱性,应选择碱式滴定管;
故答案为:烧杯、玻璃棒、胶头滴管、1000ml容量瓶;碱式;
丙:准确称取10.00g样品后,向其中加入过量的盐酸,充分反应直至样品中无气泡冒出,蒸干混合溶液将所得的固体物质置于干燥器中,冷却至室温后称量.反复加热、冷却、称量,直至所称量的固体的质量几乎不变为止,此时所得固体的质量为10.99g,设样品中碳酸钠的质量为X.
Na2CO3+2HCl=2NaCl+H2O+CO2↑ 质量差
106 117 11
X 10.99g-10.0g=0.99g
| 106 |
| 11 |
| X |
| 0.99 |
X=9.54
样品中碳酸钠的质量分数为
| 9.54g |
| 10.0g |
故答案为:95.4%
甲:称取10.0g样品,利用如图所示装置,测出反应后装置C中碱石灰增重3.52g是二氧化碳,物质的量=
| 3,52g |
| 44g/mol |
| 0.08mol×106g/mol |
| 10.0g |
故答案为:84.8%;反应生成的二氧化碳部分残留在装置A中,没有完全被装置C中的碱石灰吸收,结果偏小;
乙:准确称取10.00g样品后,配成1000mL溶液,量取25.00mL溶液放入锥形瓶中,加入2滴酚酞作指示剂,用0.15mol/L的标准盐酸滴定至终点(有关反应为Na2CO3+HCl
|
| 0.09mol×106g/mol |
| 10.0g |
故答案为:95.4%;

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案SO2是硫酸生产的重要中间产物,也是空气污染的主要原因之一,其氧化生成SO3的反应为: 2SO2(g)+O2(g)![]() 2SO3(g)。
2SO3(g)。
⑴将0.050 mol SO2(g)和0.030 mol O2(g)放入容积为1 L的密闭容器中,在一定条件下达到平衡,测得c(SO3)=0.040 mol/L。则该条件下反应的平衡常数K= ,SO2的平衡转化率为 。
⑵已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的有 (填字母)
(A)升高温度 (B)降低温度 (C)增大压强
(D)减小压强 (E)加入催化剂 (G)移出氧气
⑶若2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-197kJ·mol-1。现有甲、乙、丙三个相同的容积不变的容器,按下表中数据充入气体并反应达到平衡,放出或吸收的热量的数值分别为Q1、Q2、Q3。下列说法中不正确的是 。
2SO3(g) ΔH=-197kJ·mol-1。现有甲、乙、丙三个相同的容积不变的容器,按下表中数据充入气体并反应达到平衡,放出或吸收的热量的数值分别为Q1、Q2、Q3。下列说法中不正确的是 。
| 容器 | SO2(mol) | O2(mol) | SO3(mol) | 热量(kJ) |
| 甲 | 2 | 1 | 0 | Q1 |
| 乙 | 1 | 0.5 | 0 | Q2 |
| 丙 | 0 | 0 | 1 | Q3 |
A.Q1 = 2Q2 = 2Q3 = 197kJ
B.在上述反应中每消耗2mol SO2气体时放出的热量为197kJ
C.在上述反应中生成1mol SO3气体放热98.5kJ
D.2Q1 ??= 2Q2 < Q3 < 197kJ
⑷氨水吸收工业制硫酸尾气中的SO2的化学反应为:
![]()
![]()
下列措施中能提高燃煤烟气中![]() 去除率的有 (填字母)。
去除率的有 (填字母)。
A.增大氨水浓度 B.升高反应温度
C.使燃煤烟气与氨水充分接触 D.通入空气使HSO3-转化为SO42-
⑵已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的有 (填字母)
(A)升高温度 (B)降低温度 (C)增大压强
(D)减小压强 (E)加入催化剂 (G)移出氧气 ⑶若2SO2(g)+O2(g)2SO3(g) ΔH=-197kJ·mol-1。现有甲、乙、丙三个相同的容积不变的容器,按下表中数据充入气体并反应达到平衡,放出或吸收的热量的数值分别为Q1、Q2、Q3。下列说法中不正确的是 。| 容器 | SO2(mol) | O2(mol) | SO3(mol) | 热量(kJ) |
| 甲 | 2 | 1 | 0 | Q1 |
| 乙 | 1 | 0.5 | 0 | Q2 |
| 丙 | 0 | 0 | 1 | Q3 |
D.2Q1 = 2Q2 < Q3 < 197kJ
⑷氨水吸收工业制硫酸尾气中的SO2的化学反应为:
下列措施中能提高燃煤烟气中去除率的有 (填字母)。
A.增大氨水浓度 B.升高反应温度
C.使燃煤烟气与氨水充分接触 D.通入空气使HSO3-转化为SO42-
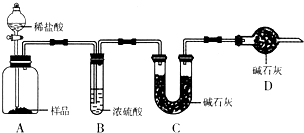 现有甲、乙、丙三个学生,欲测定某工业纯碱样品中Na2CO3的质量分数(纯碱样品中Na2CO3的质量分数为92%~96%),分别设计如下实验方案,请你帮助他们完成实验.
现有甲、乙、丙三个学生,欲测定某工业纯碱样品中Na2CO3的质量分数(纯碱样品中Na2CO3的质量分数为92%~96%),分别设计如下实验方案,请你帮助他们完成实验.
甲:用________(填实验仪器名称,不止一种,下同)称取10.0g样品,利用如图所示装置,测出反应后装置C中碱石灰增重3.52g.装置D中碱石灰的作用是________.
乙:准确称取10.00g样品后,用________(填实验仪器名称)配成1000mL溶液,用________式滴定管量取25.00mL溶液放入锥形瓶中,加入2滴酚酞作指示剂,用0.15mol/L的标准盐酸滴定至终点(有关反应为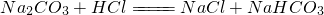 ).完成三次平行实验后,消耗盐酸体积的平均值为15.00mL.
).完成三次平行实验后,消耗盐酸体积的平均值为15.00mL.
丙:准确称取10.00g样品后,向其中加入过量的盐酸,充分反应直至样品中无气泡冒出,蒸干混合溶液将所得的固体物质置于干燥器中,冷却至室温后称量.反复加热、冷却、称量,直至所称量的固体的质量几乎不变为止,此时所得固体的质量为10.99g.请分析、计算后填表:
| 分析与计算 分组 | 计算样品中碳酸钠的质量分数 | 实验结果的评价 | 实验失败的主要原因及对结果的影响 |
| 甲 | ①________ | 失败 | ②________ |
| 乙 | ③________ | 成功 | ----- |
| 丙 | ④________ | 成功 | ---- |
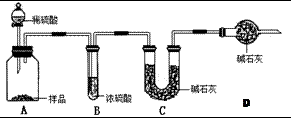 工业上制纯碱的方法是向饱和食盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,再将所得碳酸氢钠晶体加热分解后即可得到纯碱(纯碱样品中Na2CO3的质量分数为92%~96%)。涉及到的化学方程式有:
工业上制纯碱的方法是向饱和食盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,再将所得碳酸氢钠晶体加热分解后即可得到纯碱(纯碱样品中Na2CO3的质量分数为92%~96%)。涉及到的化学方程式有: