题目内容
【题目】下列有关电化学装置的说法正确的是( )
A.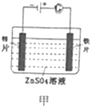 甲图装置可以实现铁片上镀锌
甲图装置可以实现铁片上镀锌
B.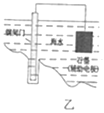 乙图表示钢闸门用牺牲阳极的阴极保护法加以防护
乙图表示钢闸门用牺牲阳极的阴极保护法加以防护
C.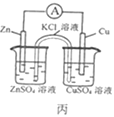 丙图中,盐桥中的K+向盛有ZnSO4溶液的烧杯中移动
丙图中,盐桥中的K+向盛有ZnSO4溶液的烧杯中移动
D.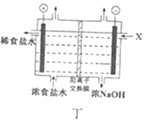 丁图中,X处补充稀NaOH溶液以增强溶液导电性
丁图中,X处补充稀NaOH溶液以增强溶液导电性
【答案】D
【解析】
A.铁片上镀锌,锌应与电源的正极相连作阳极,铁应作阴极和电源的负极相连,A错误;
B.采用牺牲阳极的阴极保护法保护钢闸门时,钢闸门作原电池正极,选取金属的金属活动性大于Fe,图象不符合,B错误;
C.丙图是原电池装置,阳离子向正极移动,Zn作负极、Cu作正极,盐桥中的钾离子向盛有硫酸铜溶液的烧杯中移动,C错误;
D.水的导电性较弱,可溶性电解质溶解于水可以增强溶液导电性,右侧得到浓的NaOH溶液,为不引进杂质,可以加入NaOH稀溶液增强溶液导电性,故D正确;
答案选D。

 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案【题目】矿物斜长石(主要成份为KAlSi3O8)在一定温度范围内用氯化钠熔浸可制得氯化钾,反应原理是NaCl(l)+KAlSi3O8(s)![]() KCl(l)+NaAlSi3O8(s)。
KCl(l)+NaAlSi3O8(s)。
(1)氯原子最外层的电子排布式___;氧原子核外电子的轨道式___;铝原子核外有___种不同能量的电子。
(2)上述反应涉及的元素中,原子半径最大的是___。该反应中位于同一周期的几种元素中,有一种元素的最高价氧化物的水化物和其余元素的最高价氧化物的水化物均能发生反应,该元素是___;从原子结构方面去分析钠元素的金属性强于铝元素的原因是___。
(3)为研究上述反应中钾元素的熔出率(液体中钾元素的质量占样品质量的百分率)与温度的关系,进行对照实验(保持其它条件不变),获得如下数据:
时间(h) 熔出率 温度 | 1.5 | 2.5 | 3.0 | 3.5 | 4.0 | 5.0 |
860℃ | 0.515 | 0.624 | 0.671 | 0.690 | 0.689 | 0.690 |
950℃ | 0.669 | 0.714 | 0.710 | 0.714 | 0.714 | ― |
①分析以上数据可以得出,氯化钠熔浸钾长石是___(填“放热”或“吸热”)反应。
②950℃时,欲提高熔出钾的速率可以采取的措施是___(选填编号)。
a.充分搅拌 b.延长反应时间
c.增大反应体系的压强 d.将钾长石粉粹成更小的颗粒
(2)该方法制得KCl提纯后可用来冶炼金属钾。反应Na(l)+KCl(l)![]() NaCl(l)+K(g)是工业上冶炼金属钾常用的方法,该方法是否能说明钠比钾更活泼?___,(填“能说明”或“不能说明”)原因是___。
NaCl(l)+K(g)是工业上冶炼金属钾常用的方法,该方法是否能说明钠比钾更活泼?___,(填“能说明”或“不能说明”)原因是___。
【题目】下表是元素周期表中的部分元素,请回答下列有关问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
4 | ⑩ |
(1)写出下列元素的符号:①______,⑥______,⑦______。
(2)上述表中的元素中,最活泼的金属元素是______(填元素符号,下同),非金属性最强的元素是______,最不活泼的元素是______。
(3)上述表中元素的最高价氧化物对应的水化物中,酸性最强的是______(填化学式,下同),碱性最强的是______,属于两性氢氧化物的是______,写出这三种物质之间相互反应的化学方程式:______,______,______。
(4)上述表中的元素(不考虑0族元素)中,原子半径最小的是______(填元素符号,下同),原子半径最大的是______。
(5)在③与④中,化学性质较活的是______(填元素符号);在⑧与中,其单质的氧化性较强的是______(填元素符号),请设计实验加以证明:______。