题目内容
在中学化学中铁及其化合物应用广泛,用所学知识回答下列问题。
(1)将一定量的铁粉在氯气中燃烧后所得固体溶于水可得到溶液X。取少量X溶液两份,一份加入KSCN溶液时,溶液显红色;另一份中加入酸性KMnO4溶液时,KMnO4溶液紫色褪去。试分析:
①溶液X含有的金属阳离子应该是 。
②用化学方程式表示上述金属阳离子产生的原因 。
③酸性KMn04溶液紫色褪去的离子方程式为 。
(2)含铬化合物有毒,通常是将废水中+6价铬(如Cr2O2—7)用还原剂还原成Cr3+,再调节溶液pH使Cr3+转化为Cr(OH)3沉淀而除去。工业上有一种电解除Cr2O2—7的方法:将含K2Cr2O7的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解。
试分析该电解除Cr2O2—7的方法中:
①阴极的电极反应式为 ;
②电解时加入氯化钠的作用是 ;
③该方法能除去Cr2O2—7的原理是 。
(1)①Fe3+和Fe2+
②2Fe+3Cl2 2FeCl3
2FeCl3+Fe=3FeCl2
2FeCl3
2FeCl3+Fe=3FeCl2
③2MnO4-+5Fe2++16H+=2Mn2++5Fe3++8H2O
(2)①2H++2e-=H2
②增强溶液导电性
③通电时,阳极Fe失去电子生成的Fe2+可还原Cr2O72-,生成的Cr3+在阴极区与OH-结合成氢氧化物沉淀而除去。
【解析】
试题分析:(1) ①“一份加入KSCN溶液时,溶液显红色;另一份中加入酸性KMnO4溶液时,KMnO4溶液紫色褪去”说明X溶液中既有Fe3+又有Fe+,所以溶液X含有的金属阳离子应该是Fe3+和Fe2+。
②2Fe+3Cl2 2FeCl3
2FeCl3+Fe=3FeCl2
2FeCl3
2FeCl3+Fe=3FeCl2
③2MnO4-+5Fe2++16H+=2Mn2++5Fe3++8H2O
(2)①在电解时,阴极得电子,发生还原反应2H++2e-=H2
② 电解时,溶液中的离子在外加电场的作用下要作定向移动,所以加NaCl是为了增强溶液的导电性。
③电解时,活性材料做阳极都是阳极溶解,Fe作阳极,Fe-2e-=Fe2+,
阴极,2H++2e-=H2,水的电离平衡被破坏,阴极区c(OH-)浓度增大。这样,Fe2+可还原Cr2O72-,生成的Cr3+在阴极区与O H-结合成氢氧化物沉淀而除去。
考点:铁及其化合物知识以及电化学知识。


 CH3CHO+H2O+Cu
CH3CHO+H2O+Cu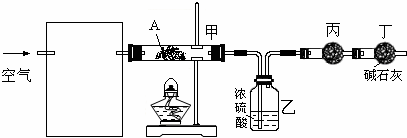
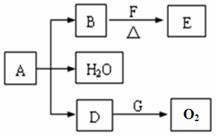
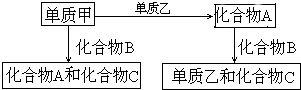 A、B、C是在中学化学中常见的三种化合物,它们各由两种元素组成,甲、乙是两种单质.这些化合物和单质之间存在如下的关系:
A、B、C是在中学化学中常见的三种化合物,它们各由两种元素组成,甲、乙是两种单质.这些化合物和单质之间存在如下的关系: