题目内容
19.下列离子化合物中,由与Ne和Ar电子层结构相同的离子组成的是( )| A. | LiBr | B. | NaCl | C. | KCl | D. | KBr |
分析 与Ne和Ar原子具有相同的电子层结构的离子分别是10电子和18电子的微粒,其中一种是阳离子一种是阴离子.
解答 解:A、锂离子是2电子的阳离子,不符合题意,故A错误;
B、钠离子是10电子的阳离子,氯离子是18电子的阴离子,可以形成化合物氯化钠,故B正确;
C、钾离子和氯离子均和氩原子具有相同的电子层结构,即均有18电子,不符合题意,故C错误;
D、钾离子是18电子的阳离子,溴离子是36电子的阴离子,不符合题意,故D错误.
故选B.
点评 本题考查了物质的组成、10电子微粒和18电子微粒,题目难度不大,根据Ne和Ar原子具有相同的电子层结构的离子分别是10电子和18电子的微粒来分析.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
9.某烃的分子式为C10H14,不能使Br2的CCl4溶液褪色,可使KMnO4(H+)溶液褪色,分子结构中只含有一个烷基,又知苯环侧链与苯环直接相连的碳上没有氢则不能被高锰酸钾氧化,则此烷基的结构有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
10.解释下列物质性质的变化规律与物质结构间的因果关系时,与键能无关的变化规律是( )
①HF、HCl、HBr、HI的热稳定性依次减弱 ②NH3易液化
③F2、Cl2、Br2、I2的熔、沸点逐渐升高 ④H2S的熔、沸点小于H2O的熔、沸点.
①HF、HCl、HBr、HI的热稳定性依次减弱 ②NH3易液化
③F2、Cl2、Br2、I2的熔、沸点逐渐升高 ④H2S的熔、沸点小于H2O的熔、沸点.
| A. | ①③④ | B. | ③④ | C. | ②③④ | D. | 全部 |
11.下列因果关系正确的是( )
| A. | 因为H2O的沸点比H2S高,所以O原子得电子能力大于S原子 | |
| B. | 因为F原子得电子能力比Cl原子强,所以氢氟酸属于强酸 | |
| C. | 因为H2CO3酸性大于H2SiO3,所以CH4稳定性大于SiH4 | |
| D. | 因为Na+KCl(熔融)=NaCl+K↑,所以Na原子失电子能力大于K原子 |
9.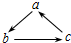 如表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
如表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
 如表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
如表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )| 物质 选 项 | a | b | c |
| A | Si | SiO2 | H2SiO3 |
| B | H2SO4 | SO2 | SO3 |
| C | Al | AlCl3 | Al(OH)3 |
| D | NaCl | Na | NaOH |
| A. | A | B. | B | C. | C | D. | D |

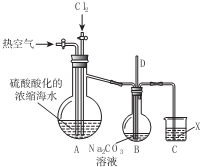 已知:Br2常温下呈液态,易挥发,有毒;如图为实验室模拟工业过程从浓缩的海水中提取溴的实验装置.其实验步骤如下:
已知:Br2常温下呈液态,易挥发,有毒;如图为实验室模拟工业过程从浓缩的海水中提取溴的实验装置.其实验步骤如下: