��Ŀ����
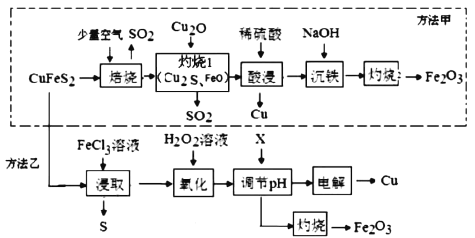
����Ŀ����ҵ�ϳ��Ի�ͭ��(��Ҫ�ɷ���CuFeS2)Ϊԭ���Ʊ�ͭ�Լ�����������(Fe2O3)�����ַ�������ʵ��ͭ��ұ�����乤��������ͼ��
�ش��������⣺
(1)Ϊʹ����������Ӧ��ֽ��У���ҵ�Ͽɲ�ȡ�Ĵ�ʩ��____(дһ��)��д����������ʱ��Ӧ�Ļ�ѧ����ʽ��___��
(2)������1�����������������õ�������____��
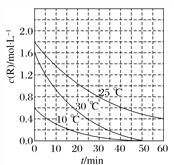
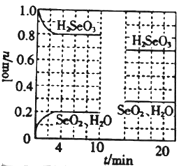
(3)FeCl3��Һ����ȡ��ʱ��ͭ�Ľ����ʽ����ͼ��ʾ����ͼ��֪����ͭ�Ľ�����Ϊ90%ʱ�������õ�ʵ������Ϊ____��д���ù�������Ӧ�����ӷ���ʽ��______��
(4)������pH�������Լ�X��_____���ù����Ŀ���dz�ȥ��Һ�е�Fe3������������Һ��pH=3.5ʱ��Fe3��______(������������������)������ȫ[c(Fe3��)��1��10��5molL��1ʱ����ΪFe3��������ȫ]������Һ��c(Cu2��)=0.2molL��1����ʱ�Ƿ���Cu(OH)2����?_______(��ʽ����)��{��֪��25��ʱ��Ksp[Fe(OH)3]��1.0��10��39��Ksp[Cu(OH)2]��2.2��10��20}
(5)�����ұȷ������ã���ԭ����_____(дһ��)��
���𰸡�������� 2CuFeS2+ 4O2![]() Cu2S+3SO2+2FeO Cu2S��Cu2O 4h��100�� CuFeS2+ 4 Fe3+= Cu2++5 Fe2++2S CuO �� ����Qc= c(Cu2+)c2(OH-)=0.2��(10-10.5)2=2��10-22��Ksp[Cu(OH)2]��2.2��10��20����Cu(OH)2���� �����������в�����SO2����Ⱦ����
Cu2S+3SO2+2FeO Cu2S��Cu2O 4h��100�� CuFeS2+ 4 Fe3+= Cu2++5 Fe2++2S CuO �� ����Qc= c(Cu2+)c2(OH-)=0.2��(10-10.5)2=2��10-22��Ksp[Cu(OH)2]��2.2��10��20����Cu(OH)2���� �����������в�����SO2����Ⱦ����
��������
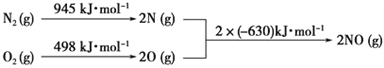
(1)����Ӱ�컯ѧ��Ӧ���ʵ����ط�����𣻸�������ͼ����������ʱCuFeS2������е�O2��Ӧ����Cu2S��SO2��FeO���ݴ���д��Ӧ�ķ���ʽ��
(2)��������ͼ��������1�������У�Cu2S��Cu2O��FeO��Ӧ������SO2��Fe2O3��Cu�����������ԭ��Ӧ�Ĺ��ɷ����жϣ�
(3)����ͼ��FeCl3��Һ����ȡ��ʱ����ͭ�Ľ�����Ϊ90%ʱ�������õ�ʵ������Ϊ4h��100�棻�ù�������У�FeCl3���������ԣ�CuFeS2��FeCl3��Һ��Ӧ������S����ϻ��ϼ۵ı仯�������ж��������������д��Ӧ�ķ���ʽ��
(4)������������Ŀ���ǽ����������������������ӣ�����pH��ʹ�����ӳ������Ӳ������µ����ʽǶȷ����жϿ���ʹ�õ��Լ�����������Һ��pH=3.5ʱ��c(OH-)=1��10��10.5molL��1�������ܶȻ����������c(Fe3��)�����Ƿ�С�ڻ����1��10��5molL��1�жϣ�����Һ��c(Cu2��)=0.2molL��1������Qc��Ksp[Cu(OH)2]�Ĵ�С�жϣ�
(5)��������ͼ�������������в�����SO2����Ⱦ�����������������������ɵ�S��������ɻ�����Ⱦ��
(1)Ϊʹ����������Ӧ��ֽ��У���ҵ�Ͽɲ�ȡ�Ĵ�ʩ�н���ͭ����顢��߷�Ӧ�¶ȵȷ�������������ͼ����������ʱ��Ӧ�Ļ�ѧ����ʽΪ2CuFeS2+ 4O2![]() Cu2S+3SO2+2FeO���ʴ�Ϊ��������壻2CuFeS2+ 4O2
Cu2S+3SO2+2FeO���ʴ�Ϊ��������壻2CuFeS2+ 4O2![]() Cu2S+3SO2+2FeO��
Cu2S+3SO2+2FeO��
(2)��������ͼ��������1�������У�Cu2S��Cu2O��FeO��Ӧ������SO2��Fe2O3��Cu����Ӧ��CuԪ�صĻ��ϼ۽��ͣ�FeԪ�غ�SԪ�صĻ��ϼ����ߣ����������õ������ǣ��ʴ�Ϊ��Cu2S��Cu2O��
(3)����ͼ��FeCl3��Һ����ȡ��ʱ����ͭ�Ľ�����Ϊ90%ʱ�������õ�ʵ������Ϊ4h��100�棻�ù�������У�FeCl3���������ԣ�CuFeS2��FeCl3��Һ��Ӧ������S��ͬʱ�������Ȼ�ͭ���Ȼ�������������Ӧ�����ӷ���ʽΪCuFeS2+ 4 Fe3+= Cu2++5 Fe2++2S���ʴ�Ϊ��4h��100�棻CuFeS2+ 4 Fe3+= Cu2++5 Fe2++2S��
(4)����(3)�з�Ӧ�ķ���ʽ��֪��������������Ŀ���ǽ����������������������ӣ�����pH��ʹ�����ӳ�����Ϊ�˲������µ����ʣ�����ѡ������ͭ��̼��ͭ�ȵ�����Һ��pH��ȥ��Һ�е�Fe3������������Һ��pH=3.5ʱ��c(OH-)=1��10��10.5molL��1����c(Fe3��)=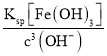 =
=![]() = 1��10��7.5molL��1��1��10��5molL��1��Fe3����ȫ����������Һ��c(Cu2��)=0.2molL��1����Qc= c(Cu2+)c2(OH-)=0.2��(10-10.5)2=2��10-22��Ksp[Cu(OH)2]��2.2��10��20����Cu(OH)2�������ʴ�Ϊ��CuO���ǣ�����Qc= c(Cu2+)c2(OH-)=0.2��(10-10.5)2=2��10-22��Ksp[Cu(OH)2]��2.2��10��20����Cu(OH)2������
= 1��10��7.5molL��1��1��10��5molL��1��Fe3����ȫ����������Һ��c(Cu2��)=0.2molL��1����Qc= c(Cu2+)c2(OH-)=0.2��(10-10.5)2=2��10-22��Ksp[Cu(OH)2]��2.2��10��20����Cu(OH)2�������ʴ�Ϊ��CuO���ǣ�����Qc= c(Cu2+)c2(OH-)=0.2��(10-10.5)2=2��10-22��Ksp[Cu(OH)2]��2.2��10��20����Cu(OH)2������
(5)�����������в�����SO2����Ⱦ�����������������������ɵ�S��������ɻ�����Ⱦ����˷����ұȷ������ã��ʴ�Ϊ�������������в�����SO2����Ⱦ������

 ������������Ӧ����ϵ�д�
������������Ӧ����ϵ�д� ͬ����չ�Ķ�ϵ�д�
ͬ����չ�Ķ�ϵ�д�