题目内容
某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,原理示意图如下,下列说法不正确的是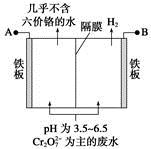
| A.A为电源正极 |
| B.阳极区溶液中发生的氧化还原反应为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O |
| C.阴极区附近溶液pH降低 |
| D.若不考虑气体的溶解,当收集到H213.44 L(标准状况)时,有0.1 mol Cr2O72-被还原 |
C
解析

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如右图所示。下列说法正确的是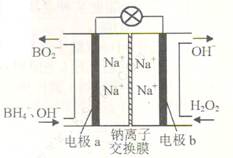
| A.电池放电时Na+从a极区移向b极区 |
| B.每消耗6molH2O2转移电子6mol |
| C.电极a采用MnO2,MnO2既作电极又有催化作用 |
| D.该电池的负极反应为:BH4-+2H2O-8e-=BO2-+8H+ |
下图是电解CuCl2溶液的装置,其中c、d为石墨电极,则下列有关的判断正确的是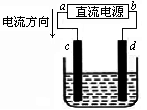
| A.a为负极、b为正极 |
| B.a为阳极、b为阴极 |
| C.电解过程中,d电极质量增加 |
| D.电解过程中,氯离子浓度不变 |
查处酒后驾驶采用的“便携式乙醇测量仪”以燃料电池为工作原理,在酸性环境中,理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为X,其中一个电极的反应式为:CH3CH2OH—2e—→X+2H+.下列说法中正确的是( )
| A.电池内部H+由正极向负极移动 |
| B.另一极的电极反应式为:O2+4e—+2H2O=4OH— |
| C.乙醇在正极发生反应,电子经过外电路流向负极 |
| D.电池总反应为:2CH3CH2OH + O2→2CH3CHO + 2H2O |
研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2—CaO作电解质,利用右图所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。下列说法中,正确的是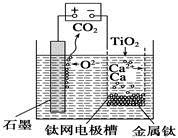
| A.由TiO2制得1 mol金属Ti,理论上外电路转移2 mol电子 |
| B.阳极的电极反应式为C+2O2--4e-=CO2↑ |
| C.在制备金属钛前后,整套装置中CaO的总量减少 |
| D.若用铅蓄电池作该装置的供电电源,“+”接线柱应连接Pb电极 |
将两个铂电极放置在KOH溶液中,然后分别向两极通入CH4和O2,即可产生电流。下列叙述正确的是
①通入CH4的电极为正极 ②正极的电极反应式为O2+2H2O+4e-=4OH- ③通入CH4的电极反应式为CH4+2O2+4e-=CO2+2H2O ④负极的电极反应式为CH4+10OH--8e-=CO32-+7H2O ⑤放电时溶液中的阳离子向负极移动 ⑥放电时溶液中的阴离子向负极移动
| A.①③⑤ | B.②④⑥ | C.④⑤⑥ | D.①②③ |
某原电池装置如图所示。下列有关叙述中,正确的是( )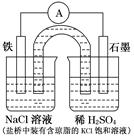
| A.Fe作正极,发生氧化反应 |
| B.负极反应:2H++2e-=H2↑ |
| C.工作一段时间后,两烧杯中溶液pH均不变 |
| D.工作一段时间后,NaCl溶液中c(Cl-)增大 |
如下图所示,其中甲池的总反应式为2CH3OH+3O2+4KOH=2K2CO3+6H2O,下列说法正确的是
| A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置 |
B.甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O=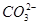 +8H+ +8H+ |
| C.反应一段时间后,向乙池中加入一定量Cu(OH)2固体能使CuSO4溶液恢复到原浓度 |
| D.甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45 g固体 |