题目内容
【题目】常温下,用0.1000molL﹣1NaOH溶液滴定20.00mL0.1000molL﹣1CH3COOH溶液所得曲线如图.下列说法正确的是( ) 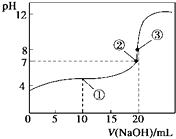
A.滴定过程中可能出现:c(CH3COOH)>c(CH3COO﹣)>c(H+)>c(Na+)>c(OH﹣)
B.①处水的电离程度大于②处水的电离程度
C.②处加入的NaOH溶液恰好将CH3COOH中和
D.③处所示溶液:c(Na+)<c(CH3COO﹣)
【答案】A
【解析】解:A.当CH3COOH较多,滴入的碱较少时,则生成CH3COONa少量,可能出现c(CH3COOH)>c(CH3COO﹣)>c(H+)>c(Na+)>c(OH﹣),故A正确;
B.点①反应掉一半醋酸,反应后溶液是CH3COONa与CH3COOH物质的量之比为1:1的混合物,醋酸电离出的氢离子抑制了水的电离,而点②处为中性溶液,所以①处水的电离程度小于②,故B错误;
C.NaOH和醋酸恰好完全反应生成CH3COONa,因CH3COO﹣水解,溶液呈碱性,而点②为中性,此时氢氧化钠少量,醋酸稍过量,故C错误;
D.点③说明两溶液恰好完全反应生成CH3COONa,因CH3COO﹣水解,则c(CH3COO﹣)<c(Na+),故D错误;
故选A.
A.在滴定中当加入碱比较少时,可能出现c(CH3COOH)>c(CH3COO﹣)>c(H+)>c(Na+)>c(OH﹣)的情况;
B.根据点①反应后溶液是CH3COONa与CH3COOH物质的量之比为1:1的混合物,溶液呈酸性,抑制了水的电离,而②为中性;
C.点②溶液的pH=7,为中性溶液,而氢氧化钠与醋酸恰好中和时生成醋酸钠,溶液呈碱性;
D.点③说明两溶液恰好完全反应生成CH3COONa,CH3COO﹣水解溶液显碱性.

 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案

