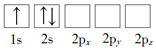
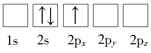
题目内容
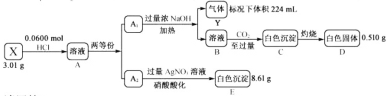
【题目】Ⅰ.化合物Ⅹ由四种短周期元素组成,加热X,可产生使湿润的红色石蕊试纸变蓝的气体Y,Y为纯净物;取![]() ,用含
,用含![]() 的盐酸完全溶解得溶液A,将溶液A分成
的盐酸完全溶解得溶液A,将溶液A分成![]() 和
和![]() 两等份,完成如下实验(白色沉淀C可溶于
两等份,完成如下实验(白色沉淀C可溶于![]() 溶液):
溶液):
请回答:
(1)组成X的四种元素是N、H和_______(填元素符号),X的化学式是_________。
(2)溶液B通入过量![]() 得到白色沉淀C的离子方程式是______________。
得到白色沉淀C的离子方程式是______________。
(3)写出一个化合反应(用化学方程式或离子方程式表示)_____________。要求同时满足:
①其中一种反应物的组成元素必须是X中除N、H外的两种元素;
②反应原理与“![]() ”相同。
”相同。
Ⅱ.某兴趣小组为验证浓硫酸的性质进行实验,如图。实验中观察到的现象有:锥形瓶内有白雾,烧杯中出现白色沉淀。请回答:
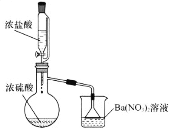
(1)将浓硫酸和浓盐酸混合可产生![]() 气体的原因是________。
气体的原因是________。
(2)烧杯中出现白色沉淀的原因是_____________。
【答案】![]()
![]()
![]()
![]()
![]() 或
或![]() 吸收浓盐酸中的水分且放热导致
吸收浓盐酸中的水分且放热导致![]() 挥发
挥发 ![]() 气体会将
气体会将![]() 带出,与
带出,与![]() 作用生成
作用生成![]()
【解析】
根据题干可知,加热X可产生能使湿润的红色石蕊试纸变蓝的纯净物气体Y,故Y为NH3,由实验流程图中分析可知,结合B中通入过量的CO2产生能溶于NaOH溶液的白色沉淀C,故C为Al(OH)3,则D为Al2O3,E是AgCl,结合图中数据利用原子守恒,可以计算出各自元素的物质的量,求出X的化学式,再根据物质性质进行解答。
Ⅰ.(1)由分析可知,Y为NH3,由实验流程图中分析可知,结合B中通入过量的CO2产生能溶于NaOH溶液的白色沉淀C,故C为Al(OH)3,则D为Al2O3,E是AgCl,利用原子守恒可知:A1溶液中含有N原子的物质的量为:![]() ,Al原子的物质的量为:
,Al原子的物质的量为:![]() ,A2溶液中含有的Cl-的物质的量为:
,A2溶液中含有的Cl-的物质的量为:![]() ;
;
故一半溶液中含有的H原子的物质的量为: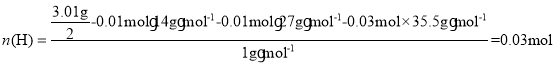 ,故X中含有四种元素即N、H、Al、Cl,其个数比为:
,故X中含有四种元素即N、H、Al、Cl,其个数比为:![]() ,故X的化学式为:AlCl3NH3,故答案为:Al Cl AlCl3 NH3;
,故X的化学式为:AlCl3NH3,故答案为:Al Cl AlCl3 NH3;
(2)根据分析(1)可知,溶液B中通入过量的CO2所发生的离子方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
(3)结合题给的两个条件,再分析化合物X(AlCl3NH3)是NH3和AlCl3通过配位键结合成的化合物,不难想到类似于NH3和H2O反应,故可以很快得出该反应的离子方程式为AlCl3+Cl-=![]() /span>或者AlCl3+NH3=AlCl3NH3,故答案为:AlCl3+Cl-=
/span>或者AlCl3+NH3=AlCl3NH3,故答案为:AlCl3+Cl-=![]() 或者AlCl3+NH3=AlCl3NH3;
或者AlCl3+NH3=AlCl3NH3;
Ⅱ.(1)由于浓硫酸具有吸水性且浓硫酸稀释是个放热过程,而且HCl的挥发性随浓度增大而增大,随温度升高而增大,从而得出用浓硫酸和浓盐酸混合制备HCl的原理是浓硫酸吸收浓盐酸中的水分且放热,使浓盐酸的挥发性增强,使HCl挥发出来,故答案为:浓硫酸吸收浓盐酸中的水分且放热,使浓盐酸的挥发性增强,使HCl挥发出来;
(2)浓硫酸虽然难挥发,但也会随HCl气流而带出少量的H2SO4分子,与Ba(NO3)2反应生成硫酸钡白色沉淀,故答案为:HCl气体能够带出H2SO4分子,与Ba(NO3)2反应生成BaSO4沉淀。

 步步高达标卷系列答案
步步高达标卷系列答案【题目】某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取。

(实验一)碘含量的测定。取0.0100mol/L的AgNO3标准溶液装入滴定管,取100.00mL海带浸取原液至滴定池,用电势滴定法测定碘含量。测得的电动势(E)反映溶液中c(I-)的变化,部分数据如下表:
V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
E/mV | -225 | -200 | -150 | -100 | 50.0 | 175 | 275 | 300 | 325 |
回答下列问题:
(1)实验中“灼烧”是在__(填仪器名称)中完成的。
(2)用文字具体描述“定容”过程:__
(3)根据表中数据判断滴定终点时用去AgNO3溶液的体积为__mL,计算得海带中碘的质量百分含量为__%。
(实验二)碘的制取。另制海带浸取原液,甲、乙两种实验方案如下:

已知:3I2+6NaOH=5NaI+NaIO3+3H2O。
(4)“适量O2”中能代替O2的最佳物质对应的电子式为__
(5)若要测定“I2+水溶液”中碘的含量,可以选择__作指示剂,用Na2S2O3溶液滴定,滴定终点的现象是__。
(6)若得到“I2+水溶液”时加入硫酸溶液过多,用Na2S2O3溶液滴定时会产生明显的误差,产生此误差的原因为__(用离子方程式表示)。