题目内容
【题目】硫酸是用途广泛的化工原料,可作脱水剂、吸水剂、氧化剂和催化剂等。
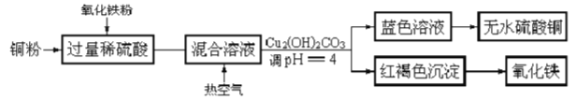
(1)工业制硫酸铜的方法很多。
①方法一、用浓硫酸和铜制取硫酸铜。该反应的化学方程式是_______________。
②方法二、用稀硫酸、铜和氧化铁制取硫酸铜,生产的主要过程如上图所示:稀硫酸和氧化铁反应的离子方程式是_________________________;铜和上述反应得到的物质反应的离子方程式是_______________;向混合溶液中通入热空气的反应的离子方程式是____________________;分离蓝色滤液和红褐色沉淀的实验操作是_____________________。
(2)氨法脱硫技术可吸收硫酸工业尾气中的二氧化硫,同时制得硫酸铵。主要的工艺流程如下图所示:
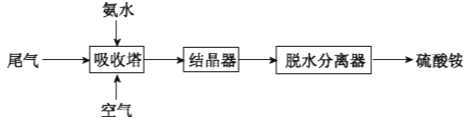
①吸收塔中发生反应的化学方程式是_________。
②检验硫酸铵中的NH4+的操作是__________________。
【答案】Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O Fe2O3+6H+=2Fe3++3H2O 2Fe3++Cu=2Fe2++Cu2+ 4Fe2++4H++O2=4Fe3++2H2O 过滤 NH3·H2O+2SO2+O2=2(NH4)2SO4+2H2O NH4++OH-
CuSO4+SO2↑+2H2O Fe2O3+6H+=2Fe3++3H2O 2Fe3++Cu=2Fe2++Cu2+ 4Fe2++4H++O2=4Fe3++2H2O 过滤 NH3·H2O+2SO2+O2=2(NH4)2SO4+2H2O NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
【解析】
(1) ①铜和浓硫酸反应生成硫酸铜和有二氧化硫和水,方程式为:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;②用稀硫酸、铜和氧化铁制取硫酸铜,氧化铁和过量的稀硫酸反应生成硫酸铁和水,硫酸铁和铜反应生成硫酸亚铁和硫酸铜,混合溶液中通入热的空气氧化亚铁离子变为铁离子,加入碱式碳酸铜调节溶液的pH沉淀铁离子生成氢氧化铁沉淀,过滤得到蓝色溶液为硫酸铜溶液,蒸发浓缩、冷却结晶、过滤洗涤、干燥得到硫酸铜晶体,红褐色沉淀氢氧化铁加热分解生成氧化铁,稀硫酸和氧化铁反应的离子方程式为Fe2O3+6H+=2Fe3++3H2O,铜和上述反应得到物质反应的离子方程式为2Fe3++Cu=2Fe2++Cu2+,向混合溶液中通入热空气的目的是,把亚铁离子氧化成铁离子,离子方程式为:4Fe2++4H++O2=4Fe3++2H2O,分离蓝色滤液和红褐色沉淀的实验操作是过滤。(2) ①依据流程图分析,吸收塔中发生反应的是二氧化硫、一水合氨和氧气反应生成硫酸铵和水,方程式为NH3·H2O+2SO2+O2=2(NH4)2SO4+2H2O;②检验铵根离子,可加入碱并加热,生成氨气,离子方程式为NH4++OH-
CuSO4+SO2↑+2H2O;②用稀硫酸、铜和氧化铁制取硫酸铜,氧化铁和过量的稀硫酸反应生成硫酸铁和水,硫酸铁和铜反应生成硫酸亚铁和硫酸铜,混合溶液中通入热的空气氧化亚铁离子变为铁离子,加入碱式碳酸铜调节溶液的pH沉淀铁离子生成氢氧化铁沉淀,过滤得到蓝色溶液为硫酸铜溶液,蒸发浓缩、冷却结晶、过滤洗涤、干燥得到硫酸铜晶体,红褐色沉淀氢氧化铁加热分解生成氧化铁,稀硫酸和氧化铁反应的离子方程式为Fe2O3+6H+=2Fe3++3H2O,铜和上述反应得到物质反应的离子方程式为2Fe3++Cu=2Fe2++Cu2+,向混合溶液中通入热空气的目的是,把亚铁离子氧化成铁离子,离子方程式为:4Fe2++4H++O2=4Fe3++2H2O,分离蓝色滤液和红褐色沉淀的实验操作是过滤。(2) ①依据流程图分析,吸收塔中发生反应的是二氧化硫、一水合氨和氧气反应生成硫酸铵和水,方程式为NH3·H2O+2SO2+O2=2(NH4)2SO4+2H2O;②检验铵根离子,可加入碱并加热,生成氨气,离子方程式为NH4++OH-![]() NH3↑+H2O。
NH3↑+H2O。