题目内容
【题目】如图所示:横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-物质的量浓度的对数,回答下列问题。
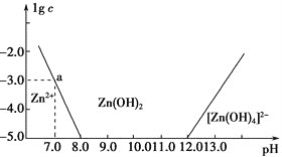
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为___。
(2)从图中数据计算可得Zn(OH)2的溶度积Ksp=___。
(3)某废液中含Zn2+,为提取Zn2+可以控制溶液pH的范围是___。
(4)泡沫灭火器内装有NaHCO3饱和溶液;灭火器内另有一容器中装有Al2(SO4) 3溶液,该溶液呈酸性的原因是:___(用离子方程式表示)。当意外失火时,使泡沫灭火器倒过来即可使药液混合,喷出CO2和Al(OH)3,阻止火势蔓延。其相关化学反应的离子方程式为:___。
【答案】Zn2++4OH-=[Zn(OH)4]2- 10-17 8<pH<12 Al3+ + 3H2O![]() Al(OH)3+3H+ Al3++3HCO3-
Al(OH)3+3H+ Al3++3HCO3-![]() Al(OH)3↓+3CO2↑
Al(OH)3↓+3CO2↑
【解析】
(1)根据图像进程判断;
(2)根据图像a点计算;
(3)提取某废液中含Zn2+时,应使溶液中的Zn2+变为Zn(OH)2;
(4)Al2(SO4) 3为强酸弱碱盐,NaHCO3为强碱弱酸盐,混合时相互促进水解。
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,根据图像可知,氢氧根过量时生成[Zn(OH)4]2-,则反应的离子方程式为Zn2++4OH-=[Zn(OH)4]2-;
(2)根据图像,a点时,溶液的pH=7,lgc(Zn2+)=-3,常温时,则c(OH-)=10-7mol/L,c(Zn2+)=10-3mol/L,Ksp=c(Zn2+)×c2(OH-)=10-17;
(3)提取某废液中含Zn2+时,应使溶液中的Zn2+变为Zn(OH)2,根据图像可知,氢氧化锌时的pH值为8<pH<12;
(4)Al2(SO4) 3为强酸弱碱盐,溶液中铝离子发生水解反应生成氢氧化铝和氢离子,导致溶液中的氢离子浓度大于氢氧根离子浓度,使溶液显酸性,离子反应为Al3+ + 3H2O![]() Al(OH)3+3H+;碳酸氢根离子与铝离子相互促进水解,可生成氢氧化铝沉淀和二氧化碳气体,反应的离子方程式为Al3++3HCO3-
Al(OH)3+3H+;碳酸氢根离子与铝离子相互促进水解,可生成氢氧化铝沉淀和二氧化碳气体,反应的离子方程式为Al3++3HCO3-![]() Al(OH)3↓+3CO2↑。
Al(OH)3↓+3CO2↑。