题目内容
【题目】短周期元素 Q、R、T、W 在元素周期表中的位置如图所示,其中T 所处的周期序数与主族序数相等,请回答下列问题:
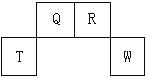
(1)W 在周期表中的位置是____________, Q、R、T 三种元素原子的半径从大 到小排列顺序_____________ (用元素符号表示),Q 的最高价氧化物的电子 式________________,R 气态氢化物分子的结构式为_______________。
(2)元素的原子得电子能力:Q________________W(填“强于”或“弱于”)。
(3)T、Q、R、W 的单质中,固态时属于原子晶体的是______________(填名称)。
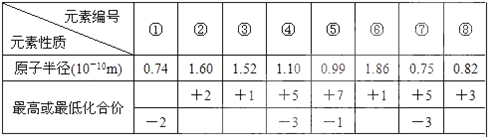
(4)现有 8 种元素的性质、数据如下表所列,它们属于短周期:请指出 R 元素在下表中的对应编 号__________________ ,与 T 同周期且最高价氧化物的水化物碱性最强的元素在下表中的对应编 号_____________。
【答案】 第 3 周期ⅥA 族 Al>C>N ![]()
![]() 弱于 金刚石 ⑦ ⑥
弱于 金刚石 ⑦ ⑥
【解析】试题分析:T 所处的周期序数与主族序数相等,所以T是第3周期、第ⅢA族元素, T是Al元素,则Q、R、W分别是C、N、S元素。根据表格数据,①的化合价为-2,①是O元素;⑤的化合价是+7、-1,所以⑤是Cl元素;④⑦的化合价都是+5、-3,半径④>⑦,所以④是P元素、⑦是N元素;③⑥的化合价都是+1,根据半径,③⑥不可能是H元素,半径③<⑥,所以③是Li元素、⑥是Na元素;②的化合价为+2,半径大于锂,所以②是Mg元素;⑧的化合价为+3,半径小于P,所以⑧是B元素;
解析:根据以上分析,(1)W 是S元素,在周期表中的位置是第 3 周期ⅥA 族,Al、C、N 三种元素原子,Al电子层数最多,半径最大,C、N电子层数相同,C的质子数少,半径大,所以半径从大 到小排列顺序Al>C>N,C的最高价氧化物是CO2,CO2是共价化合物,电子式是 ![]() ,N气态氢化物是氨气,分子的结构式为
,N气态氢化物是氨气,分子的结构式为![]() 。
。
(2)S的非金属性大于C元素,所以原子得电子能力:C弱于S。
(3)Al、C、N、S 的单质中,金刚石属于原子晶体。
(4)根据分析, R 是N元素,表中⑦是N元素,所以R对应编号是⑦, T 是是第3周期元素,同周期元素中最高价氧化物的水化物碱性最强的是氢氧化钠,钠元素对应的编号是⑥。

 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案

