题目内容
铝和铍的性质相似,下列关于Be的性质的推断正确的是 ( )A.Be能与强碱溶液反应
B.Be(OH)2可溶于水
C.BeCl2与NaOH不反应
D.氧化铍的化学式为Be2O3
提示:
| 由铝和铍的性质相似为依据做题,铝可以和强碱溶液反应,所以Be也能与强碱溶液反应;氢氧化铝不溶于水,所以B错;氯化铝能与NaOH反应,所以BeCl2也能与NaOH反应,所以C错;Be是第二主族,为正二价,所以氧化铍为BeO,D错。
|

已知:①常温下KSP=[Fe(OH)3]=4×10-38,lg2≈0.3 ②有关金属离子形成氢氧化物沉淀时的pH如下表:
| 开始沉淀时的pH | 完全沉淀时的pH | |
| Fe3+ | 2.7 | x |
| Y3+ | 6.0 | 8.2 |
(1)钇矿石(Y2FeBe2Si2O10)的组成用氧化物的形式可表示为
(2)欲从Na2SiO3和Na2BeO2的混合溶液中制得Be(OH)2沉淀.则
①最好选用盐酸、
a.NaOH溶液b.氨水c.CO2气d.HNO3
②写出Na2BeO2与足量盐酸发生反应的离子方程式:
(3)一般认为离子浓度小于1×10-5mol?L-1为沉淀完全,试计算Fe3+完全沉淀时x=
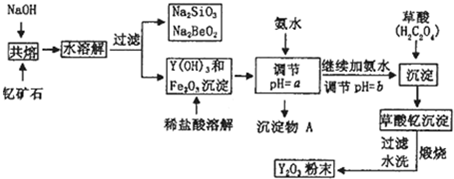
(11分)Ⅰ.“中东有石油,中国有稀土”。稀土金属是我国战略性资源,应加以保护。稀土金属是周期表中ⅢB族中钪、钇和镧系十七种元素的总称,都是很活泼的金属,性质极为相似,常见化合价为+3价。钇(Y)元素是激光和超导的重要材料。我国蕴藏着丰富的钇矿石(Y2FeBe2Si2O10),以此矿石为原料生产氧化钇(Y2O3)的主要流程如下:

已知:①有关金属离子形成氢氧化物沉淀时的pH如下表:
|
离子 |
开始沉淀时的pH |
完全沉淀时的pH |
|
Fe3+ |
2.7 |
3.7 |
|
Y3+ |
6.0 |
8.2 |
②在周期表中,铍、铝元素处于第二周期和第三周期的对角线位置,化学性质相似。
(1)欲从Na2SiO3和Na2BeO2的混合溶液中制得Be(OH)2沉淀。则最好选用盐酸和 (填字母)
两种试剂,通过必要的操作即可实现。
A.NaOH溶液 B、氨水 C、CO2 D、HNO3
(2)流程图中用氨水调节pH=a时生成沉淀的化学式为 ,继续加氨水调至pH=b,此时发生反应的离子方程式为 。
(3)沉淀C为草酸钇,写出草酸钇隔绝空气加热生成Y2O3的化学方程式: 。
Ⅱ镧系元素铈(Ce)是地壳中含量最高的稀土元素,在加热的条件下CeCl3易发生水解。
(4)无水CeCl3可用加热CeCl3·6H2O和NH4Cl固体混合物的方法来制备,其中NH4Cl的作用是___
。
(5)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过反应形成Ce(OH)4沉淀得以分离, 写出反应的离子方程式 。



