题目内容
100mL0.3mol·L-1Na2SO4溶液和50mL0.2mol·L-1Al2(SO4)3溶液混合后,溶液中SO42-离子的物质的量浓度(设体积为二者之和)为( )
A.0.2mol?L-1 B.0.25 mol?L-1 C.0.4 mol?L-1 D、0.5 mol?L-1
C
解析试题分析:n(SO42-)=0.1×0.3mo·L-1+0.05L×3×0.2mol·L-1=0.06mol.C(SO42-)="n/V=0.06mol/0.15L=0.4" mol/L.选项为:C
考点:考查混合溶液中微粒的物质的量浓度的计算的知识。

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
实验室里需要480 mL 0.1mol/L的硫酸铜溶液,现选取500 mL容量瓶进行配制,以下操作正确的是[胆矾(CuSO4·5H2O)]
| A.称取7.68 g硫酸铜,加入500 mL水 |
| B.称取12.0 g胆矾配成500 mL溶液 |
| C.称取8.0 g硫酸铜,加入500 mL水 |
| D.称取12.5 g胆矾配成500 mL溶液 |
如图所示,常温常压下气体X(见选项)与O2等物质的量混合后充满圆底烧瓶,挤压胶头滴管并打开止水夹,可观察到烧杯中的水沿导管进入烧瓶。长时间充分反应后,烧瓶中所得溶液的物质的量浓度最小的是(假设溶质不向烧瓶外扩散)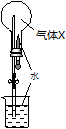
| A.NH3 | B.HCl | C.SO2 | D.NO2(假设不含N2O4) |
设NA为阿伏加德罗常数的值,下列说法正确的是
| A.一定条件下,2.3g金属钠与氧气完全反应失电子数为0.1NA |
| B.常温常压下,氧气和臭氧(O3)的混合物32g中含有NA个氧原子 |
| C.1molOH- 中含有的电子数为9NA |
| D.0.1mol/L硫酸铝溶液中含有硫酸根的个数为0.3NA |
在标准状况下,将某X气体V L溶于水中,得到12mol·L-1的溶液500mL,则气体的体积V是( )
| A.134.4L | B.67.2L | C.44.8L | D.537.6L |
下列叙述中错误的是
| A.相同体积的任何气体都含有相同数目的原子 |
| B.标准状况下,5L H2S气体与5L NH3的原子个数比为3∶4 |
| C.同温同压下相同体积的N2气和CO气体有相同物质的量和相同的质量 |
| D.当粒子数相同时,气体的体积主要决定于气体粒子之间的距离 |
设NA为阿伏伽德罗常数,下列叙述正确的是( )
| A.24g镁的原子最外层电子数为NA |
| B.1L0.1mol/L乙酸溶液中H+数为0.1NA |
| C.1mol甲烷分子所含质子数为10NA |
| D.标准状况下,22.4L乙醇的分子数为NA |
乙醇(C2H6O)水溶液中,当乙醇分子和水分子中氢原子个数相等时,溶液中乙醇的质量分数为( )
| A.20% | B.50% | C.46% | D.32% |
设NA为阿伏加德罗常数的值。下列说法正确的是
| A.标准状况下,22.4LCCl4含有C-Cl键的数目为4NA |
| B.常温常压下,44 g由N2O与CO2组成的混合气体含有的氧原子数目为NA |
C.反应NH4N3 2N2↑+2H2↑,常温常压下每生成22.4LlN2,转移电子的数目为4NA 2N2↑+2H2↑,常温常压下每生成22.4LlN2,转移电子的数目为4NA |
| D.1 L 1 mol·L-1的AlCl3溶液中含有Cl-的数目为3NA |