题目内容
图为某化学反应速率一时间图。在 时刻升高温度或增大压强,都符合下图所示变化的反应是
时刻升高温度或增大压强,都符合下图所示变化的反应是

 时刻升高温度或增大压强,都符合下图所示变化的反应是
时刻升高温度或增大压强,都符合下图所示变化的反应是
A.2SO2(g)+O2(g) 2SO3(g);ΔH<0 2SO3(g);ΔH<0 |
B.4NH3(g)+5O2(g) 4NO(g)+6H2O(g);ΔH<0 4NO(g)+6H2O(g);ΔH<0 |
C.H2(g)+I2(g) 2HI(g); ΔH>0 2HI(g); ΔH>0 |
D.C(s)+H2O(g) CO(g)+H2(g) ;ΔH>0 CO(g)+H2(g) ;ΔH>0 |
B
试题分析:由图可知:增大压强或升高温度,正反应、逆反应的速率都增大,但逆反应速率增大的多,化学平衡逆向移动。根据勒夏特列原理,增大压强,化学平衡向气体体积减小的方向移动。升高温度,化学平衡向吸热方向移动。即该反应的逆反应是气体体积减小的吸热反应。正反应是气体体积扩大的放热反应。A 正反应是气体体积减小的反应,错误。B正反应是气体体积扩大的放热反应。正确。C反应是等体积反应,错误。D正反应是吸热反应,错误。

练习册系列答案
相关题目
 2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断
2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断
 2NH3(g)合成氨,下列叙述正确的是
2NH3(g)合成氨,下列叙述正确的是 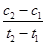
 2SO3(g),ΔH < 0的正、逆反应速率的影响如图所示:
2SO3(g),ΔH < 0的正、逆反应速率的影响如图所示:

 CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是