题目内容
已知Ba(AlO2)2可溶于水,向含有1 mol Al2(SO4)3的溶液中加入含有b mol Ba(OH)2 (b≠6)的溶液,所得沉淀的物质的量不可能为
A.5mol B.3mol C.b/2mol D.5b/3mol
C
【解析】
试题分析:1 mol Al2(SO4)3则溶液中含有2 mol Al3+、3 mol SO42-,向溶液中逐滴加入Ba(OH)2溶液时发生的反应为:Al3++3OH-=Al(OH)3↓、SO42-+Ba2+=BaSO4↓。则当2 mol Al3+完全沉淀时,消耗Ba(OH)2 3 mol,此时生成沉淀为2 mol Al(OH)3和3 mol BaSO4共5 mol;再加入Ba(OH)2溶液时发生Al(OH)3+OH-=AlO2-+2H2O, 沉淀的量将逐渐减少,如果氢氧化钡过量,则生成的氢氧化铝全部溶解,生成Ba(AlO2)2,此时沉淀的就只有硫酸钡,其物质的量是3mol;如果硫酸铝过量,则bmol氢氧化钡生成的沉淀是bmol+2b/3mol=5b/3mol,即选项C是不可能的,答案选C。
考点:考查氢氧化钡和硫酸铝反应的有关计算
点评:该题是高考中的常见题型,属于中等难度的试题。试题贴近高考,综合性强,在注重对学生基础知识巩固与训练的同时,侧重对学生能力的培养与解题方法的指导和训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和发散思维能力。该题的关键是明确反应原理,然后根据反应的方程式并结合题意灵活运用、分析、判断、讨论即可。

 名校课堂系列答案
名校课堂系列答案已知Ba(AlO2)2可溶于水,向含有1 mol Al2(SO4)3的溶液中加入含有b mol Ba(OH)2 (b≠6)的溶液,所得沉淀的物质的量不可能为
| A.5mol | B.3mol | C.b/2mol | D.5b/3mol |
已知Ba(AlO2)2可溶于水。下图表示的是向含A12(SO4)3 0.01mol的溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系(其中a、c分别是0b段和bd段的中点)。下列有关叙述正确的是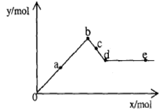
| A.a时沉淀的质量为3.495 g |
| B.b时沉淀的物质的量为0.05 mol |
| C.c时溶液中Ba2+离子的物质的量为0.005 mol |
| D.e时溶液中AlO2—的物质的量为0.01 mol |