题目内容
【题目】下列离子方程式的书写正确的是
A. 氯气通入水中,溶液呈酸性:Cl2 + H2O ![]() 2H+ + Cl+ClO
2H+ + Cl+ClO
B. AlCl3溶液中加入过量的浓氨水:Al3+ + 3NH3H2O = Al(OH)3 ↓ + 3NH4+
C. 钠和冷水反应:Na+2H2O=Na++2OH+H2↑
D. 向FeCl3溶液中加入铁粉:Fe3+ + Fe = 2Fe2+
【答案】B
【解析】A、次氯酸是弱电解质,氯气通入水中,溶液呈酸性:Cl2 + H2O ![]() H+ + Cl+HClO,故错误;B、一水合氨是弱碱,AlCl3溶液中加入过量的浓氨水:Al3+ + 3NH3H2O = Al(OH)3 ↓ + 3NH4+,故B正确;C、钠和冷水反应:2Na+2H2O=2Na++2OH+H2↑,故C错误;D、向FeCl3溶液中加入铁粉:2Fe3+ + Fe = 3Fe2+,故D错误;故选B。
H+ + Cl+HClO,故错误;B、一水合氨是弱碱,AlCl3溶液中加入过量的浓氨水:Al3+ + 3NH3H2O = Al(OH)3 ↓ + 3NH4+,故B正确;C、钠和冷水反应:2Na+2H2O=2Na++2OH+H2↑,故C错误;D、向FeCl3溶液中加入铁粉:2Fe3+ + Fe = 3Fe2+,故D错误;故选B。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案【题目】为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。
实验Ⅰ 反应产物的定性探究
实验装置如图所示。![]() 固定装置已略去
固定装置已略去![]()
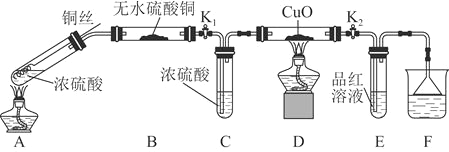
(1)A中反应的化学方程式为____________。
(2)F烧杯中的溶液通常是________________。
(3)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是______。
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是______。
(5)为说明浓硫酸中的水是否影响B装置现象的判断,还须进行一次实验。实验方案为_______。
实验Ⅱ 反应产物的定量探究
(6)在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料。
资料1:
硫酸(mol/L) | 黑色物质出现的温度(℃) | 黑色物质消失的温度(℃) |
15 | 约150 | 约236 |
16 | 约140 | 约250 |
18 | 约120 | 不消失 |
资料2:X射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种。仅由上述资料可得出的正确结论是_________。
a.铜与浓硫酸反应时所涉及的反应可能不止一个
b.硫酸浓度选择适当,可避免最后产物中出现黑色物质
c.该反应发生的条件之一是硫酸浓度≥15mol/L
d.硫酸浓度越大,黑色物质越快出现、越难消失
(7)为测出硫酸铜的产率,将该反应所得溶液中和后配制成250.00mL溶液,取该溶液25.00mL加入足量KI溶液振荡,以淀粉溶液为指示剂,用bmol/LNa2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液V mL。若反应消耗铜的质量为a g,则硫酸铜的产率为________。(已知:2Cu2++4I-=2CuI+I2,2S2O32-+I2=S4O62-+2I-)
【题目】四氯化锡可用作媒染剂。利用如图所示装置可以制备四氯化锡(部分夹持装置已略去);
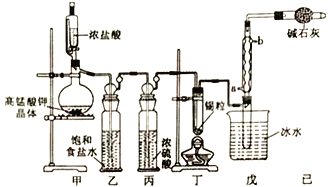
有关信息如下表:
化学式 | SnCl2 | SnCl4 |
熔点/℃ | 246 | -33 |
沸点/℃ | 652 | 144 |
其他性质 | 无色晶体,易氧化 | 无色液体,易水解 |
回答下列问题:
(1)戊装置中冷凝管的进水口为___________(填“a”或“b”)。
(2)用甲装置制氯气,MnO4-被还原为Mn2+,该反应的离子方程式为________________________。
(3)将装置如图连接好,检查气密性,慢慢滴入浓盐酸,待观察到___________(填现象)后,开始加热丁装置,锡熔化后适当增大氯气流量,继续加热丁装置,此时继续加热丁装置的目的是:①促进氯气与锡反应;②_______________________________。
(4)如果缺少乙装置,可能产生的后果是___________________;己装置的作用是__________________。
(5)某同学认为丁装置中的反应可能产生SnCl2杂质,以下试剂中可用于检测是否产生SnCl2 的有_______________(填标号)。
a.FeCl3溶液(滴有KSCN) b.H2O2溶液 C.溴水 d.AgNO3溶液
(6)反应中用去锡粒1.19g,反应后在戊装置的试管中收集到2.38 gSnCl4,则SnCl4的产率为____________________。
【题目】已知几种物质的相对能量如下表所示:
物质 | NO2(g) | NO(g) | SO2(g) | SO3(g) |
相对能量/kJ | 429 | 486 | 99 | 0 |
工业上,常利用下列反应处理废气:NO2(g)+SO2(g)=NO(g)+SO3(g) △H等于
A. +42kJ·mol-1 B. -42kJ·mol-1 C. -84kJ·mol-1 D. +84kJ·mol-1