题目内容
【题目】实验室通常用MnO2和浓盐酸共热制取Cl2,反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)该反应的氧化剂是_____________,氧化产物是_____________,用双线桥或单线桥法表示上述反应电子转移的方向和数目____________________________________。
(2)计算当有73.0克HCl被氧化时,消耗MnO2的质量为_____________。
(3)在反应MnO2+4HCI![]() MnCl2+C12↑+2H2O中,当有0.2mol电子转移时,产生氯气的体积(标准状况)是____________。
MnCl2+C12↑+2H2O中,当有0.2mol电子转移时,产生氯气的体积(标准状况)是____________。
【答案】 MnO2 Cl2 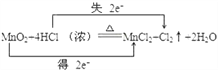 87g 2.24L
87g 2.24L
【解析】(1)Mn元素化合价从+4价降低到+2价,得到电子,因此该反应的氧化剂是MnO2,Cl元素化合价从-1价升高到0价,失去电子,氯化氢是还原剂,所以氧化产物是Cl2,根据电子得失守恒可知用双线桥表示该反应电子转移的方向和数目为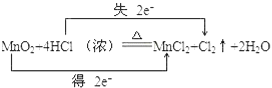 ;(2)73.0克HCl的物质的量是73g÷36.5g/mol=2mol,失去2mol电子,所以根据电子得失守恒可知消耗MnO2的物质的量是2mol÷2=1mol,质量为1mol×87g/mol=87g。(3)产生1mol氯气转移2mol电子,当有0.2mol电子转移时,产生氯气的物质的量是0.1mol,在标准状况下的体积是2.24L。
;(2)73.0克HCl的物质的量是73g÷36.5g/mol=2mol,失去2mol电子,所以根据电子得失守恒可知消耗MnO2的物质的量是2mol÷2=1mol,质量为1mol×87g/mol=87g。(3)产生1mol氯气转移2mol电子,当有0.2mol电子转移时,产生氯气的物质的量是0.1mol,在标准状况下的体积是2.24L。

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目




